HIV hoạt động như thế nào?
Tổ chức Y tế thế giới (WHO) ước tính, HIV vẫn là một vấn đề sức khỏe cộng đồng lớn trên toàn cầu trong tương lai. Cho đến nay, nó đã cướp đi sinh mạng của 40,1 triệu người cho đến nay. Riêng trong năm 2021, khoảng 650 người chết vì các nguyên nhân liên quan đến HIV và có đến 1,5 triệu người nhiễm mới HIV [1]. Đại dịch HIV xuất hiện lần đầu tiên vào năm 1981, khi nó được xác định như một căn bệnh mới trong quần thể người trên toàn thế giới và đặc trưng bởi sự suy giảm hệ thống miễn dịch [2]. Tác nhân HIV là một retrovirus mang cấu trúc bộ gen gồm 2 phân tử axit ribonucleic sợi đơn (RNA) giống hệt nhau [3]. Nhiễm HIV ở người tiến triển qua 3 giai đoạn: nhiễm trùng cấp tính, nhiễm trùng mạn tính và AIDS. Ở giai đoạn nhiễm trùng cấp tính, một lượng lớn virus lưu hành trong hệ thống tuần hoàn, do đó rất dễ lây lan và có thể có hoặc không có các triệu chứng. Ở giai đoạn mạn tính, tải lượng vi rút thấp hơn giai đoạn cấp tính, các cá nhân vẫn có khả năng lây nhiễm nhưng thường không có triệu chứng. Giai đoạn cuối là AIDS, xảy ra khi số lượng tế bào CD4+ giảm xuống rất thấp. Đây là thời điểm khi các bệnh nhiễm trùng cơ hội phát triển [4].
Tế bào miễn dịch bao gồm bạch cầu trung tính, bạch cầu ưa axit, bạch cầu ưa kiềm, tế bào mast, bạch cầu đơn nhân mono, đại thực bào, tế bào đuôi gai và tế bào lympho (tế bào B và tế bào T). HIV xâm nhập các tế bào miễn dịch bao gồm tế bào T CD4+ và bạch cầu đơn nhân dẫn đến giảm số lượng tế bào T xuống dưới mức tới hạn và mất khả năng miễn dịch qua trung gian tế bào. Sự lây nhiễm HIV của các tế bào T xảy ra thông qua tương tác ái lực cao giữa glycoprotein (gp120) có trong vỏ virion và phân tử CD4. Virus lây nhiễm qua tế bào T và bạch cầu đơn nhân bằng cách tương tác với các đồng thụ thể tương ứng của chúng là CXCR4 và CCR5. Sau khi virus đã gắn và xâm nhập vào tế bào chủ, retrovirus sử dụng enzyme sao chép ngược để sao chép RNA của nó thành axit deoxyribonucleic (DNA). Những bản sao DNA mới này sau đó rời khỏi tế bào vật chủ và tiếp tục lây nhiễm sang các tế bào khác trong vật chủ [5].
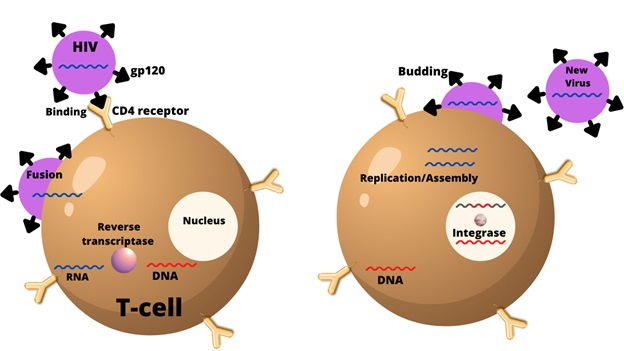
Tương tác giữa tế bào T và HIV.
Chú thích: HIV: human immunodeficiency virus; CD4 receptor: thụ thể CD4; RNA: ribonucleic acid; DNA: deoxyribonucleic acid; gp120: glycoprotein 120 (Nguồn: cureus.com).
Vì sao lại là liệu pháp tế bào gốc?
Tế bào gốc - Stem cell là những tế bào hình thành nên cơ thể. Các tế bào chuyên hóa của cơ thể ở các mô hay cơ quan khác nhau (ví dụ như tế bào gan ở gan, tế bào cơ ở cơ hay tế bào tim ở tim gọi là những những tế bào chuyên hóa chức năng hay những tế bào đã biệt hóa) đều có nguồn gốc từ những tế bào gốc ban đầu, những tế bào gốc ban đầu này hình thành không lâu sau quá trình thụ tinh của giao tử. Cơ thể của chúng ta duy trì trong suốt đời là nhờ vào sự tồn tại của các tế bào gốc ở các mô hằng ngày vẫn sửa chữa các tổn thương và thay thế các tế bào bị mất đi mỗi ngày ở các mô như da, tóc, máu hay ở đường tiêu hóa. Dựa vào vị trí hay giai đoạn thu nhận tế bào gốc trong cơ thể. Có thể chia tế bào gốc thành các loại tế bào gốc chính gồm: tế bào gốc phôi - embryonic stem cell là những tế bào tồn tại trong giai đoạn sớm của quá trình phát triển; tế bào gốc ở mô hay tế bào gốc trưởng thành “tissue - specific” hay “adult” stem cell tồn tại trong suốt quá trình phát triển thai và trong suốt đời sống của cơ thể. Tế bào gốc trưởng thành có mặt trong các sinh vật sau khi ra đời. Những tế bào này có thể biểu hiện dưới dạng tế bào gốc đơn tiềm năng (unipotent) hoặc đa tiềm năng (multipotent). Cơ quan chứa nhiều tế bào gốc trưởng thành thường là tủy xương với tỷ lệ tế bào gốc đa tiềm năng cao. Những tế bào này có khả năng tăng trưởng, biệt hóa và tạo ra toàn bộ các dòng tế bào tạo máu. Thông thường, các tế bào này không phân chia liên tục. Mục đích chính của tế bào gốc trưởng thành là tái tạo và thay thế các tế bào đã chết, do nguyên nhân tự nhiên hoặc bệnh lý. Bằng cách xem xét khả năng tái tạo này, tế bào gốc có tính ứng dụng cao trong quá trình điều trị các rối loạn thoái hóa [6].
Hiện nay, liệu pháp kháng virus hoạt tính cao (HAART) vẫn được coi nền tảng để điều trị HIV. Tuy nhiên, HAART có liên quan đến nhiều biến chứng trong quá trình điều trị. Quan trọng hơn, vấn đề tuân thủ nghiêm ngặt phác đồ điều trị của các thuốc này cũng gây khó khăn không nhỏ cho người bệnh. Do đó, cần phải có một giải pháp thay thế khả thi hơn. Sự phát triển của các chiến lược điều trị mới này đòi hỏi giải quyết vô số mối quan tâm về tính an toàn và hiệu quả. Trọng tâm chính của HIV/AIDS là có sự thuyên giảm tình trạng nhiễm trùng cơ hội trong suốt vòng đời của người bệnh. Cho đến nay, trường hợp đầu tiên và duy nhất được ghi nhận khỏi HIV sau khi cấy ghép tế bào gốc tủy xương đã được báo cáo vào năm 2009. Ông Timothy Ray Brown (hay còn biết đến với tên gọi là bệnh nhân Berlin) - một bệnh nhân dương tính với HIV đã được cấy ghép thành công tế bào gốc tủy xương đồng hợp tử CCR5 kháng HIV tự nhiên Δ32/Δ32 sau khi người này được chẩn đoán bệnh bạch cầu dòng tủy cấp tính trước đó. Một cách thú vị, “thành tựu từ trên trời rơi xuống” này đã khơi mào cho một làn sóng quan tâm bất tận đến việc thúc đẩy liệu pháp tế bào gốc để chữa trị HIV lâu dài [6].
Ý tưởng đằng sau liệu pháp định hướng gen bằng tế bào gốc/tế bào đầu dòng tạo máu (HSPC) chống HIV chính là biến đổi gen các HSPC được lấy từ bệnh nhân (tự thân) để có được khả năng kháng nhiễm HIV vốn có. Về lý thuyết, các HSPC được thiết kế kháng HIV có khả năng sinh ra các thế hệ tế bào con cháu kháng HIV trong thời gian dài sau khi cấy ghép. Nhiều phương pháp trị liệu gen dựa trên tế bào gốc đã được đề xuất như thuốc có tích hợp gen kháng HIV hay tái tổ hợp vật liệu di truyền để tạo ra các HSPC biến đổi gen kháng HIV. Gần đây, một số nghiên cứu đã chỉ ra sự phát triển của các gen kháng HIV chống lại thụ thể chemokine CCR5 rất có tiềm năng. Đồng thụ thể CCR5 đã được chứng minh đóng một vai trò quan trọng trong quá trình lây nhiễm HIV. Đáng chú ý, các nghiên cứu đã phát hiện không có tác dụng phụ nào trong hệ thống tạo máu và hệ thống miễn dịch của con người sau khi ức chế biểu hiện CCR5, ngoại trừ một số trường hợp nhiễm trùng nặng hơn do các loại virus khác gây ra như West Nile gây viêm não đã được báo cáo. Đột biến CCR5 Δ32/Δ32 mang lại khả năng chống lại sự lây truyền HIV tự nhiên ở những người có sẵn đột biến này ở dạng đồng hợp tử. Trong trường hợp đột biến dị hợp, có thể làm cho quá trình tiến triển thành AIDS diễn ra chậm hơn vài năm so với các cá thể bình thường. Hơn nữa, các công nghệ chỉnh sửa gen đang có hiện nay CRISPR hoặc ZFN (zinc finger nuclease) đều có thể tạo ra cơ chế ức chế CCR5 [6].
Một cơ chế khác của liệu pháp tế bào gốc là bảo vệ tế bào gốc tạo máu (HSC) và bạch cầu. Loại tế bào bạch cầu của con người bao gồm các tế bào T CD4, cụm tế bào T biệt hóa 8 (CD8), tế bào B, bạch cầu ái toan, bạch cầu trung tính, bạch cầu ái kiềm, tế bào tiêu diệt tự nhiên, đại thực bào/bạch cầu đơn nhân, tế bào thần kinh đệm nhỏ và tế bào đuôi gai. Trong quá trình phát triển, bạch cầu của con người biểu hiện phân tử CD4 trên bề mặt của chúng. Vì các đồng thụ thể HIV cũng biểu hiện phân tử CD4 nên chúng dễ bị nhiễu loạn hoặc lây nhiễm trực tiếp. Ở một người bị nhiễm HIV, các loại tế bào bạch cầu của con người có thể hoạt động như một nhóm virus. Một liệu pháp tế bào gốc thành công có thể bảo vệ cả dòng tế bào T và tế bào dòng tủy. Phương pháp điều trị cho bệnh nhân nhiễm HIV dựa trên việc liệu HSC có thể được bảo vệ và giữ cho bạch cầu khỏi bị lây nhiễm hay không. Các nghiên cứu về phương pháp này hiện nay đang phát triển. Nhiều phương thức trị liệu gen bao gồm shRNA (short hairpin RNA), ZFN (zinc finger nuclease), protein âm tính chiếm ưu thế, RNA mồi nhử, kháng thể nội bào và ribozyme chống HIV đã hạn chế khả năng phân chia của virus hoặc làm cho tế bào ít bị lây nhiễm hơn [6].
Những kết quả ban đầu
Kể từ sau thành công của bệnh nhân Berlin, đã có nhiều thử nghiệm về việc sử dụng liệu pháp tế bào gốc trên bệnh nhân HIV. Một báo cáo gần đây của các nhà khoa học đến từ Khoa Y - Đại học Cornell, Hoa Kỳ (Weill Cornell Medicine) cho thấy, một bệnh nhân nhiễm HIV được ghép tế bào gốc đã không còn định lượng được virus trong 14 tháng sau khi ngừng điều trị bằng thuốc kháng virus HIV. Người này cũng được chẩn đoán mắc bệnh bạch cầu cấp dòng tủy trước đó. Bệnh nhân được cấy ghép tế bào gốc tạo máu và tế bào miễn dịch sau khi quần thể các tế bào máu của chính cô ấy (gồm cả tế bào bạch cầu) bị phá hủy bởi hóa trị liệu liều cao. Các tế bào được cấy ghép đến từ 2 nguồn: tế bào gốc từ một người họ hàng trưởng thành khỏe mạnh được sử dụng để giúp nhanh chóng khôi phục quần thể tế bào máu của cô ấy nhằm giảm các biến chứng nhiễm trùng; máu cuống rốn từ một đứa trẻ sơ sinh không có quan hệ huyết thống được sử dụng để cung cấp quá trình tái tạo máu lâu dài. Các bác sỹ trong trường hợp này đã sử dụng máu cuống rốn có chứa một biến thể gen kháng HIV gọi là CCR5 Δ 32. Ba tháng sau ca ghép, các xét nghiệm cho thấy quần thể tế bào máu của bệnh nhân hoàn toàn có nguồn gốc từ tế bào máu cuống rốn kháng HIV. Các nghiên cứu sau cấy ghép không còn có thể phát hiện HIV bằng các xét nghiệm có độ nhạy khác nhau. Bệnh nhân cuối cùng đã ngừng dùng thuốc kháng virus để ngăn chặn sự lây nhiễm HIV. Cho đến nay, đã ngừng dùng thuốc kháng HIV được 14 tháng, bệnh nhân không có dấu hiệu tái phát HIV, khi theo dõi chặt chẽ trong đại dịch COVID-19. Điều này cho thấy khả năng chữa khỏi, mặc dù các bác sỹ muốn gọi nó là giai đoạn thuyên giảm lâu dài của bệnh HIV. Bệnh nhân cũng đã không còn bệnh bạch cầu trong hơn 4 năm [7]. Gần đây nhất, tại Hội nghị AIDS quốc tế lần thứ 24 - AIDS 2022 (tháng 8/2022), một người đàn ông ở miền nam California, được mệnh danh là “Bệnh nhân của thành phố Hy vọng” (City of Hope patient) là người mới nhất được chữa khỏi HIV sau khi được cấy ghép tế bào gốc từ một người hiến tặng mang đột biến hiếm gặp, nâng tổng số ca ghép tế bào gốc điều trị khỏi HIV lên con số 5. Theo báo cáo, các xét nghiệm cho thấy, người đàn ông này đã đạt được “100% chimerism”, nghĩa là tất cả các tế bào miễn dịch của anh ta đều có nguồn gốc từ người hiến tặng. Anh ấy tiếp tục điều trị thuốc kháng virus ARV (dolutegravir, tenofovir alafenamide và emtricitabine) trong 2 năm sau khi cấy ghép. Vào thời điểm đó, với tải lượng virus HIV không thể phát hiện được, anh ấy được dừng điều trị với ARV[8].
Một trong những thách thức chính trong việc loại trừ HIV là việc chức năng miễn dịch của cơ thể bị suy giảm cũng như khả năng phục hồi miễn dịch không hoàn toàn do nhiễm trùng gây ra. Trái ngược với hầu hết các liệu pháp kháng virus chính thống, HSC biến đổi gen có khả năng liên tục tạo ra các tế bào miễn dịch để có thể tấn công liên tục virus HIV. Do đó, một chiến lược điều trị thành công có khả năng kiểm soát sự lây nhiễm HIV ở trạng thái ổn định. Cuối cùng là loại trừ HIVra khỏi bệnh nhân chỉ bằng một lần điều trị duy nhất hoặc tối thiểu. Ngoài ra, tại nang bạch huyết - một cấu trúc miễn dịch quan trọng, các phản ứng miễn dịch kéo dài để tạo ra các kháng thể chống lại virus [9]. Nang này cũng như cơ chế bảo vệ của chúng bị suy giảm rất sớm sau khi nhiễm HIV. Nhiễm HIV dẫn đến tổn thương nghiêm trọng các tế bào miễn dịch T ở niêm mạc ruột và phá vỡ hàng rào biểu mô ruột, dẫn đến thủng ruột. Mặc dù thuốc kháng virus có hiệu quả trong việc ngăn chặn sự nhân lên của virus, nhưng chúng lại không hiệu quả trong việc phục hồi những tổn thương do HIV gây ra trong hệ thống miễn dịch. Thuốc kháng virus không thể khôi phục chức năng của các nang bạch huyết bị tổn thương do nhiễm HIV. Các nghiên cứu đã chỉ ra rằng, các MSC có nguồn gốc từ tủy xương có thể thay đổi và khôi phục các vị trí niêm mạc bị tổn thương với sự gia tăng nhanh chóng các kháng thể và tế bào miễn dịch T nhắm vào virus. Do đó, tế bào gốc đã có khả năng phục hồi hệ thống miễn dịch [10].
Mặc dù, các nhà nghiên cứu vẫn đang cố gắng tìm hiểu lý do tại sao sau khi ghép tế bào gốc lại thành công trong khi những nỗ lực khác lại thất bại. Một số người cho rằng, phản ứng thải ghép có thể đóng một vai trò trong việc loại bỏ HIV, tuy nhiên ngay cả khi có thêm nhiều trường hợp được báo cáo thì ghép tế bào gốc vẫn còn rất rủi ro đối với những người không cần chúng để điều trị bệnh ung thư. Do vật chủ hay người được ghép là “ngoại lai”, các tế bào miễn dịch của người hiến tặng có thể tấn công các mô và cơ quan của người nhận, điều này cần đến liệu pháp ức chế miễn dịch. Ngoài ra, trong khi chờ người hiến các tế bào gốc, bệnh nhân HIV rất dễ tiến triển nặng hơn. Hơn nữa, quy trình này hiện nay rất đắt đỏ và khó có thể nhân rộng quy mô để điều trị cho hàng triệu người nhiễm HIV trên toàn thế giới.
Tài liệu tham khảo
[1] https://www.who.int/news-room/fact-sheets/detail/hiv-aids.
[2] J.A. Levy (2009), “HIV pathogenesis: 25 years of progress and persistent challenges”, AIDS, 23, pp.147-160.
[3] E. Fanales Belasio, et al. (2010), “HIV virology and pathogenetic mechanisms of infection: a brief overview”, Ann Ist Super Sanita, 46, pp.5-14.
[4] https://www.cdc.gov/hiv/basics/whatishiv.html 2021.
[5] https://www.ipmglobal.org/how-hiv-infects-cell.
[6] K. Khalid, et al. (2021), “Stem Cell Therapy and Its Significance in HIV Infection”, Cureus, 13(8), DOI: 10.7759/cureus.17507.
[7] https://news.weill.cornell.edu/news/2022/02/patient-possibly-cured-of-hiv-infection-by-special-stem-cell-transplant.
[8] https://www.aidsmap.com/news/aug-2022/california-man-appears-be-another-person-cured-hiv-after-stem-cell-transplant.
[9] L.A. Hirao, et al. (2014), “Early mucosal sensing of SIV infection by paneth cells induces IL-1β production and initiates gut epithelial disruption”, PLoS Pathog, 10, DOI: 10.1371/journal.ppat.1004311.
[10] M.G. Weber, et al. (2021), “Gut germinal center regeneration and enhanced antiviral immunity by mesenchymal stem/stromal cells in SIV infection”, JCI Insight, 6, DOI: 10.1172/jci.insight.149033.