Sự ra đời của Retron
Trong những năm gần đây, CRISPR-Cas9 đã trở thành hệ thống chỉnh sửa gen bậc nhất trong mảng y - sinh học nhờ vào khả năng “lập trình” để tìm và cắt các đoạn mã hóa đặc biệt trên DNA. Tuy nhiên việc chỉnh sửa DNA để tạo ra các đột biến/chỉnh sửa đột biến như mong muốn đòi hỏi phải có sự hỗ trợ từ tế bào để sửa chữa vết cắt, bên cạnh đó là nguy cơ gây độc tế bào nếu Cas9 cắt các vị trí ngoài mục tiêu. Nhằm mục tiêu cải thiện những hạn chế của hệ CRISPR-Cas9, các nhà khoa học Mỹ đã nghiên cứu ra một phương pháp chỉnh sửa gen mới bằng plasmid được gọi là Retron với nhiều ưu điểm vượt trội.
Retron ra mắt lần đầu trên tạp chí Cell vào năm 1984 ở vi khuẩn Myxobacteria xanthus khi mà nhà khoa học người Mỹ Thomas Yee và cộng sự vô tình phát hiện một cấu trúc vệ tinh ngắn RNA-DNA trong quá trình điện di DNA chromosome. Những nghiên cứu sau đó xác định được các DNA mạch đơn có khả năng sao chép DNA số lượng lớn (multicopy single-stranded DNAs, msDNA) bao gồm một cấu trúc RNA (msr) gắn với một đoạn DNA (msd) có khả năng phiên mã ngược để tạo thành đoạn DNA mạch đơn (single stranded DNA, ssDNA).
Việc xuất hiện hàng trăm đoạn mã hoá đã thúc đẩy các nhà khoa học phát triển một quy ước gọi tên một cách hệ thống cho từng loại retron. Do đó, retron được đặt tên theo các chữ cái đầu tiên của tên chi, tên loài và độ dài của DNA được phiên mã ngược từ trình tự msDNA nguyên thuỷ. Quy ước này được Inouye và các cộng sự đề ra vào năm 1989 để gọi tên một retron được phân lập từ E. coli (Eco86),
Cùng với CRISPR-Cas9, retron chính là một khám phá mới mang tính đột phá trong lĩnh vực chỉnh sửa gen một cách chính xác và linh hoạt ở vi khuẩn, nấm và thậm chí là tế bào con người. Nói một cách dễ hiểu, công nghệ chỉnh sửa gen dựa vào kỹ thuật tái tổ hợp đòi hỏi tích hợp ssDNA chứa đột biến mong muốn vào DNA của sinh vật, thường được làm theo hai cách sau: Một là DNA mạch đôi sẽ được cắt (ví dụ như bằng CRISPR-Cas9) để tích hợp đoạn mã hóa đột biến vào hệ gen của tế bào thông qua quá trình sửa chữa, hai là đưa đoạn DNA đột biến và protein sao mã mạch đơn (single-stranded annealing protein, SSAP) vào tế bào đang trong giai đoạn sao mã để protein tích hợp đoạn DNA đột biến vào DNA của tế bào con. Retron chính là công cụ đại diện cho phương pháp thứ hai (hình 1).
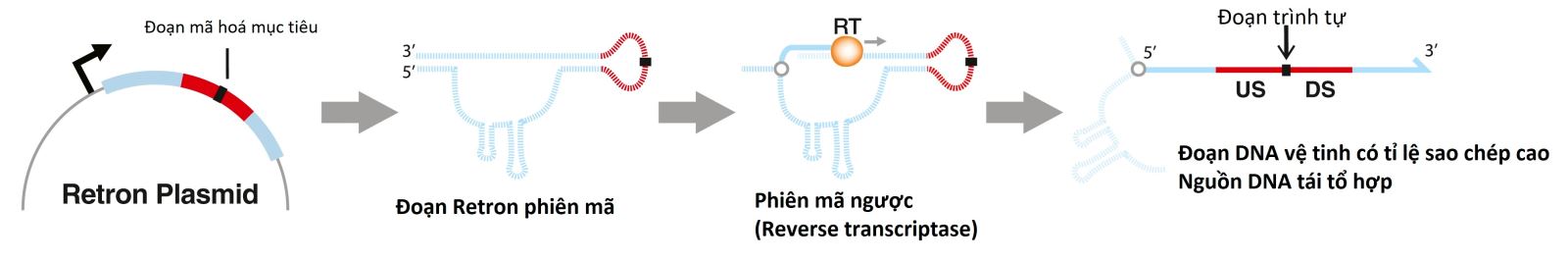
Hình 1. Cơ chế cơ bản của phiên mã ngược với retron.
Tháng 4/2021, các nhà khoa học tại Viện Wyss, Trường Đại học Harvard, Mỹ đã công bố nghiên cứu mới của họ về Hệ tái tổ hợp retron (Retron Library Recombineering, RLR) có khả năng sản xuất ssDNA từ chính trong tế bào mục tiêu, không đòi hỏi phải cố gắng đưa đoạn DNA vào trong tế bào, không làm tổn thương tính toàn vẹn của DNA sinh vật chủ. Hơn thế, đoạn mã hóa của retron còn có khả năng đánh dấu vi khuẩn chứa chính đoạn mã hóa đó, tạo điều kiện phân loại sàng lọc dòng đột biến chính xác và nhanh hơn (hình 2).
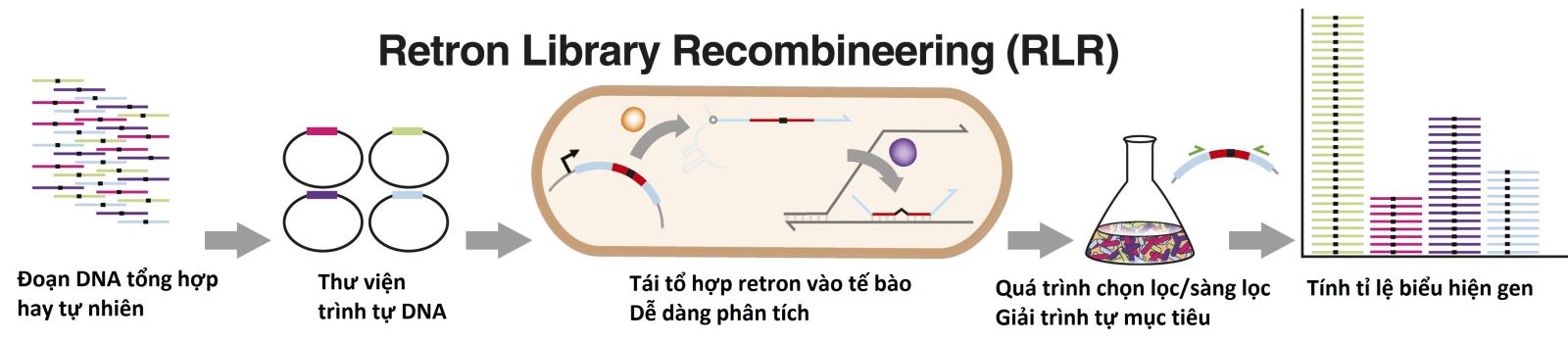
Hình 2. Quy trình tạo lập và phân tích nguồn tái tổ hợp retron
Để kiểm tra hiệu quả tái tổ hợp gen giữa retron và DNA vật chủ, gen kháng kháng sinh và protein có chức năng sao mã được tích hợp vào retron vi khuẩn (hình 3). Ở những thử nghiệm đầu tiên cho thấy <0,1% vi khuẩn E. Coli mang retron tái tổ hợp mong muốn. Nhằm cải thiện hiệu suất, vi khuẩn được chỉnh sửa gen để vô hiệu hóa bộ máy sửa chữa đột biến trong tế bào, là nguyên nhân khiến retron không thể truyền qua thế hệ tiếp theo. Bên cạnh đó, hai gen của vi khuẩn mã hóa cho exonuclease - là enzym phá hủy ssDNA tự do - cũng bị bất hoạt. Nhờ hai tác động trên mà tỷ lệ vi khuẩn kết hợp với trình tự retron tăng lên đáng kể, hơn 90% số vi khuẩn.
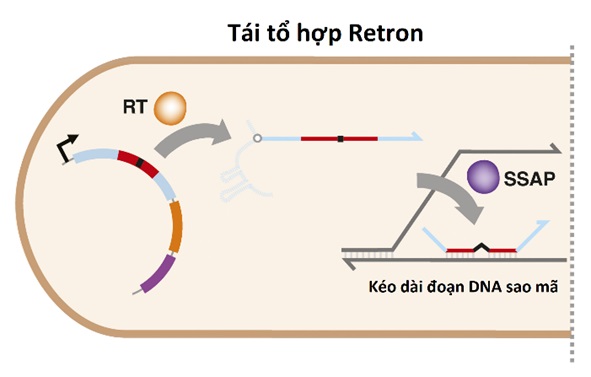
Hình 3. Mô tả cơ chế tái tổ hợp retron vào hệ gen của tế bào.
Ưu thế vượt trội của Retron
Retron được ưu ái bởi kích thước nhỏ gọn, các vị trí bắt đầu và kết thúc phiên mã ngược được xác định rõ ràng, không đòi hỏi các yếu tố vật chủ và không chứa các đoạn DNA dễ chuyển đổi vị trí, hạn chế đột biến trong quá trình hoạt động.
Mỗi plasmid có trình tự retron duy nhất, có thể hoạt động như một “thẻ tên”, hỗ trợ giải trình tự retron ngắn hơn thay vì phải giải trình tự toàn bộ bộ gen của vi khuẩn để xác định đột biến mà tế bào đã nhận được. Cơ chế này được thực hiện qua việc retron đủ nhạy và chính xác để đo lường những khác biệt nhỏ về sức đề kháng do các đột biến tương tự nhau gây ra cũng như do gen kháng kháng sinh tồn tại trong vi khuẩn rất nhiều. Sau khi các dữ liệu này được thu thập, thay vì phân lập và giải trình tự các đột biến riêng lẻ, vi khuẩn sẽ được giải trình tự mã vạch, đẩy nhanh quá trình sàng lọc đột biến.
Không chỉ thế, dữ liệu về DNA phân mảnh ngẫu nhiên còn được thu thập tạo lập một “thư viện” trình tự di truyền trong retron của plasmid. Nhờ vào tính đơn giản của RLR tạo thuận lợi cho việc dễ dàng phân tích các đoạn mã hoá mà các nhà khoa học có thể xây dựng một thư viện mã di truyền lớn hơn nhiều so với CRISPR-Cas9, công cụ đòi hỏi phải tổng hợp cả trình tự DNA hướng dẫn và trình tự DNA gốc để tạo ra đột biến. Xây dựng thư viện trình tự di truyền có ý nghĩa lớn trong việc tối ưu hoá quy trình tạo đột biến, thực hiện đồng thời hàng triệu thí nghiệm, quan sát tác động của các đột biến trên toàn bộ hệ gen cũng như tương tác giữa các đột biến, mở ra nhiều ý tưởng mới cho nghiên cứu di truyền trong tương lai.
Một đặc điểm khác giúp RLR vượt trội hơn CRISPR là tỷ lệ vi khuẩn tích hợp thành công đột biến vào bộ gen sẽ tăng lên theo thời gian khi vi khuẩn tái tạo, trong khi đó phương pháp cắt của CRISPR có thể thành công hoặc thất bại chỉ sau một lần thử nghiệm đầu tiên. Do đó, RLR có thể kết hợp với CRISPR để cải thiện hiệu suất hoặc RLR có thể thay thế CRISPR trong trường hợp chống chỉ định do độc tính của CRISPR.
Hiệu quả sao chép gen bằng retron
Để bàn về vấn đề này, một nghiên cứu mới nhất đăng trên tạp chí Nature vào tháng 2/2022 đã đánh giá hiệu quả phiên mã ngược bằng cách sử dụng retron để sản xuất DNA trong tế bào vi khuẩn E. coli.
Một operon retron tiêu biểu có chứa một enzym phiên mã ngược (reverse transcriptase, RT), một đoạn RNA không mã hóa (non-coding RNA, ncRNA) vừa là đoạn mồi vừa là đoạn mẫu cho quá trình phiên mã ngược kèm với một hoặc một vài protein hỗ trợ (hình 3)
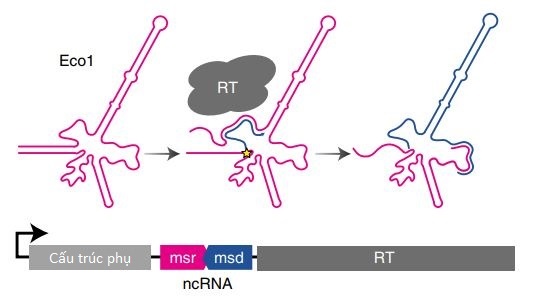
Hình 4. Mô tả cấu trúc ncRNA.
ncRNA có thể phân nhỏ thành một vùng mã hoá ngược (msd) và một vùng chứa RNA (msr), hai vùng có thể chồng lấp một phần lên nhau. Quá trình phiên mã ngược sẽ phiên mã ncRNA thành đoạn RT-DNA mạch đơn kèm với một cấu trúc “kẹp tóc” (hairpin) có chiều dài giao động từ 48-163 bp. Khi đưa ncRNA và RT từ plasmid vào vi khuẩn E. coli cho biểu hiện đoạn RT-DNA/plasmid gấp 8-10 lần so với đoạn plasmid đơn độc, thể hiện khả năng tăng cường sao mã của RT-DNA. Bên cạnh đó, trong nghiên cứu trên, nhóm tác giả đã phát hiện ra các yếu tố làm tăng sản xuất RT-DNA bao gồm chiều dài đoạn gốc msd (stem length) từ 12-30bp, chiều dài đoạn quai (loop length) dưới 14bp và chiều dài đoạn bổ sung a1/a2 (là vùng cấu trúc ncRNA nơi mà đầu 5’ và 3’ kết thúc và gập lại với nhau) không được ngắn dưới 7bp.
Trong tế bào nấm men Saccharomyces cerevisiae, bằng phương pháp kéo dài đoạn Eco1 a1/a2 từ 12-27, retron đã sản xuất đoạn RT-DNA nhiều hơn 3-4 lần. Tuy nhiên khi so sánh với tế bào người thì retron lại có hiệu quả thấp hơn 10-100 lần so với tế bào nấm men, và hiệu quả sản xuất RT-DNA không khác biệt bất kể nhóm nghiên cứu tăng hay giảm chiều dài của đoạn a1/a2. Có thể do khác biệt về khả năng trình diện đoạn a1/a2 hoặc do khác biệt đặc tính sửa chữa DNA của hai loại tế bào.
Ở tế bào nhân thực, RT-DNA có thể trở thành khuôn mẫu trong quá trình chỉnh sửa gen bằng cách tích hợp vào bộ gen của tế bào, do đó biến đổi bộ gen của một nửa thế hệ “con cháu” của tế bào đó. Chỉnh sửa ncRNA bằng cách kéo dài đoạn a1/a2 có thể tăng tỉ lệ biểu hiện gen mục tiêu.
Không chỉ thế, khi biểu hiện ncRNA cùng với Cas9 có nguồn gốc từ Streptococcus pyogenes (SpCas9) và gRNA (là đoạn mã hoá tích hợp với ncRNA, hay còn gọi là gRNA/scaffold, tạm dịch là RNA hướng dẫn kèm cấu trúc khung) trong tế bào nhân thực, vị trí đột biến được cắt và sửa chữa lại một cách chính xác bằng cách sử dụng khuôn mẫu RT-DNA. Hiệu quả của bộ ba ncRNA, gRNA và Cas9 trong chỉnh sửa gen tỉ lệ thuận với độ dài vùng a1/a2 của ncRNA.
Ở tế bào người, việc chỉnh sửa gen khó hơn do biểu hiện của promoter phức hợp gen Cas9-retron khác biệt và tế bào người có cơ chế chỉnh sửa gen phức tạp hơn so với nấm men và tế bào nhân sơ. Nhìn chung, RT-DNA làm tăng hiệu quả và độ chính xác khi chỉnh sửa vị trí đột biến trong gen hơn. Thú vị hơn là, khi có mặt RT-DNA, tỷ lệ vị trí chỉnh sửa không chính xác giảm tương tự mức tăng của các vị trí chỉnh sửa chính xác, cho thấy rằng RT-DNA đang được sử dụng như một khuôn mẫu để chỉnh sửa các vị trí không chính xác hiện có trong gen.
Retron là một bước tiến ấn tượng đưa kỹ thuật gen lên một tầm cao mới và chắc chắn sẽ còn mang đến những cải tiến mới, thú vị và bất ngờ. Trong tương lai, khi mà chúng ta có thể tiếp tục phát triển retron nhằm chỉnh sửa đoạn gen bệnh trong tế bào người sẽ còn mang lại một tia hy vọng mới trong điều trị các loại bệnh mang tính chất di truyền như thiếu máu hồng cầu liềm, alpha- và beta- thalassemia... cùng nhiều bệnh lý di truyền khác.
TÀI LIỆU THAM KHẢO
1. https://wyss.harvard.edu/news/move-over-crispr-the-retrons-are-coming/.
2. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6868368/.
3. https://www.scientificamerican.com/article/mysterious-retron-dna-helps-scientists-edit-human-genes/.
4. https://www.nature.com/articles/s41589-021-00927-y.