Sơ lược về Fz
Hệ thống chỉnh sửa trình tự gen với phân tử RNA dẫn đường (guided RNA, gRNA) là đề tài đạt giải Nobel Hoá học năm 2020. Từ đó đến nay, hệ thống này nắm giữ vai trò quan trọng bậc nhất trong những nghiên cứu di truyền, điển hình là hệ chỉnh sửa gen CRISPR-Cas. Mặc dù cũng có nhiều nghiên cứu trên sinh vật nhân thực, bao gồm RNA can thiệp hay điều hoà RNA ribosom, nhưng vẫn chưa rõ liệu tế bào nhân thực có tồn tại men cắt và gRNA hay không. Gần đây, một hệ thống chỉnh sửa trình tự gen mới ở sinh vật nhân sơ với tên gọi OMEGA đã được phát hiện. Men cắt của hệ OMEGA là TnpB - tiền thân giả định của Cas12 và với khả năng cắt nucleotit dưới định hướng của gRNA. Tnp cũng có thể là tiền thân của protein Fz mã hoá transposon ở tế bào nhân thực, có chức năng endonuclease (cắt liên kết phosphodiester trong chuỗi polynucleotit). Trong một công bố trên Tạp chí Nature, nhóm nghiên cứu thuộc MIT đã thành công khi chứng minh được Fz chính là thành viên đầu tiên thuộc hệ thống chỉnh sửa trình tự gen OMEGA của tế bào nhân thực. Fz có đặc điểm sinh hoá như một endonuclease với gRNA, kèm theo đó là vùng lõi với cấu trúc tương tự Cas12 và TnpB (hình 1).
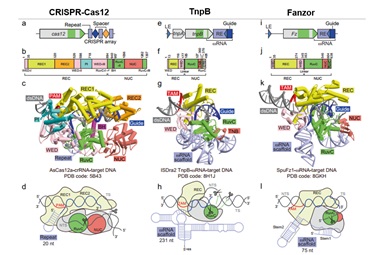
Hình 1. Cấu trúc và cơ chế hoạt động của Fz khi so sánh với Cas12a và TnpB.
Fz được công bố lần đầu vào năm 2013, là một protein tương tự TnpB-IS200/IS605. Ban đầu, Fz và TnpB được cho là có chức năng điều hoà hoạt động của một số yếu tố thông qua quá trình methyltransferase. Tuy nhiên, gần đây các nhà khoa học phát hiện ra chức năng của TnpB thuộc nhóm OMEGA. Hệ OMEGA bao gồm một protein endonuclease với gRNA (TnpB, IscB hoặc IsrB) và một RNA không mã hoá (non coding RNA, ncRNA) phiên mã từ vùng cuối Tranposon (vùng DNA có thể di chuyển trong bộ gen làm tăng tính đa dạng di truyền) còn được gọi là ωRNA. OMEGA là tiền thân của hệ CRISPR-Cas và TnpB có mối liên hệ với men Cas12. Do đó các nhà khoa học đưa ra giả thiết, Fz cũng thuộc hệ chỉnh sửa gen OMEGA của tế bào nhân thực.
Chức năng endonuclease của Fz
Đầu tiên, nhóm nghiên cứu tại MIT thực hiện phân tích phát sinh chủng loại (Phylogenomic analysis), tức là nghiên cứu hệ gen về quá trình tiến hoá, phát triển sinh vật, mối liên quan giữa các loài, từ đó phát hiện ra Fz cũng tồn tại ở nhiều loại sinh vật nhân thực đa dạng khác. Mặc dù trình tự và kích thước có sự khác biệt lớn, nhóm nghiên cứu tìm ra được giữa các hệ thống chỉnh sửa gen có những cấu trúc vùng (domain) giống nhau bao gồm vùng WEB và vùng RuvC, là vùng mã hoá chức năng endonuclease với RNA dẫn đường. Sự khác biệt cấu trúc giữa TnpB và Fz chỉ ra quá trình chọn lọc tự nhiên có liên quan đến cơ chế và/hoặc hoạt động của những hệ chỉnh sửa gen này, nhưng những vùng chính yếu và những vị trí xúc tác hoạt động được bảo tồn qua các hệ chỉnh sửa gen khác nhau cho thấy, Fz có thể có chức năng chỉnh sửa gen qua gRNA.
Để kiểm tra hoạt động endonuclease qua gRNA của Fz, nhóm nghiên cứu đã chọn SpuFz1, là Fz của một loại nấm cư ngụ trong đất Spizellomyces punctatus do đặc điểm có vùng REC (REC domain) lớn hơn so với các Fz từ các sinh vật khác, với tổng locus mã hoá khoảng 2.1 kbp. Phân tích vùng mã hoá cùng giải mã RNA của SpuFz1, nhóm tìm ra một ωRNA 88-90 nt (nucleotit) chứa đoạn mã bảo tồn 75 nt được mã hoá từ vùng cánh phải của gen Fz và một đoạn mã đa dạng 14-15 nt tại đầu 3’, tạo nên hoạt động toàn vẹn của ωRNA. Một vài loại ωRNA từ các loài khác cũng cho kết quả tương tự như trên. Dựa trên căn bản về cấu trúc tương tự nhau giữa TnpB và Cas12, nhóm nghiên cứu đưa ra giả thiết Fz cũng thực hiện chức năng cắt DNA, với đầu 3’ của ωRNA có nhiệm vụ như một đoạn mã hoá dẫn đường để gắn Fz tới DNA mục tiêu.
Để kiểm tra giả thiết này, nhóm thực hiện phương pháp cắt trong phòng thí nghiệm, sử dụng lại phương pháp đoạn mã hoá mục tiêu (target-adjacent motif - TAM) như đã sử dụng cho hệ chỉnh sửa gen OMEGA. Đầu mã 3’ của ωRNA được thay thế bằng trình tự 30 nt tương ứng với một vùng mục tiêu gần với vùng 8 bp ngẫu nhiên chọn từ thư viện plasmid. Sản phẩm cắt sau đó được giải trình tự, kết quả cho thấy có tăng số lượng trình tự 5’ của vùng 8bp (đoạn TAM) trong trình tự mục tiêu. Phương pháp giải trình tự Sanger sản phẩm cắt cho thấy sản phẩm cắt chỉ chứa một kiểu hình cắt độc nhất, tức là Fz cắt tại vị trí đặc trưng của mạch đôi. Không chỉ thế, khi nhóm sử dụng đoạn TAM bị đột biến thì kết quả cho thấy không có hoạt động cắt, chỉ ra rằng chức năng endonuclease có mối liên hệ chặt chẽ với đoạn TAM hay nói cách khác là gRNA. Hoạt động cắt của SpuFz1 cần có magie, canxi và mangan cùng với khoảng giao động nhiệt rộng (4 đến 70°C) tương ứng với đặc tính của sinh vật chủ S. punctatus. Không giống như TnpB và Cas12, Fz không xảy ra hiện tượng cắt không đặc hiệu dsDNA, dsRNA, ssDNA hay ssRNA của môi trường mà chỉ gắn với dsDNA mục tiêu. Bên cạnh SpuFz1, có thêm 3 loại Fz nữa được đưa vào thí nghiệm tương tự như trên, trong số đó có 3 loại cho hiệu quả chỉnh sửa gen tổng thể tương tự như với loại protein đã được nghiên cứu trước đây là AsCas12f1. Trong thời gian sắp tới, nếu nhóm nghiên cứu có thể tối ưu hoá hoạt động của SpuFz1 cùng với ωRNA sẽ mang lại một giải pháp mới trong phương pháp chỉnh sửa gen ở người. Một điều thú vị khác là khi giải trình tự các locus của các Fz khác nhau, nhóm nghiên cứu phát hiện ra từng loại Fz có kiểu hình chèn/cắt khác nhau, ví dụ như SpuFz1 và NlovFz2 có kiểu cắt lớn hơn, tương tự với AsCas12a, MmeFz2 lại có kiểu cắt độc đáo 1 bp, tương tự với AsCas12f1.
Cấu trúc của Fz dưới kính hiển vi điện tử lạnh (Cryo-EM)
Tiếp theo, nhóm nghiên cứu xem cấu trúc của SpuFz1 trong phức hợp với ωRNA và dsDNA mục tiêu dưới kính hiển vi điện tử lạnh (cryo-EM). SpuFz1 có cấu trúc hai thuỳ gồm REC và NUC, một đặc điểm thường thấy ở Cas12 và TnpB. Thuỳ REC chứa vùng REC và vùng WEB, thuỳ NUC chứa vùng RuvC và NUC. Đoạn TAM được nhận diện qua vùng REC và WEB, trong khi đó đoạn chứa RNA dẫn được nằm tại vùng REC và RuvC. Vùng stem1 và một phần vùng stem2 của khung ωRNA tăng cường tương tác với vùng WED, RuvC và NUC, mà không tạo thành tương tác giữa vùng nhân-vùng xa của stem2 và SpuFz1. Dựa trên thông tin cấu trúc này, nhóm nghiên cứu thử nghiệm với một đoạn ωRNA tối giản hơn, cắt đi đoạn stem2 và kiểm tra khả năng chỉnh sửa hệ gen người, vùng đơn RuvC (single RuvC) sẽ chịu trách nhiệm cắt DNA. Trong thí nghiệm này, một phân tử nước giả định ngay lập tức gắn với chuỗi bên của đoạn xúc tác chính trong vùng hoạt động của RuvC và nhóm phosphate trong stem-loop1 của ωRNA, cho thấy ωRNA có thể ổn định vùng hoạt động và đóng góp vào quá trình cắt DNA.
So sánh cấu trúc giữa AsCas12a, ISDra2 TnpB và SpuFz1 cho thấy các đặc điểm riêng biệt trong từng nhóm bao gồm cấu trúc bậc ba của khung RNA, cấu trúc vùng và thành phần của protein, nhưng lại có chung một cơ chế cắt mục tiêu DNA dựa trên gRNA. Các nhóm này có thuỳ REC để phát hiện đoạn PAM/TAM và thuỳ NUC để cắt DNA. Đặc biệt hơn, AsCass12a chứa vùng REC lớn gồm REC1 và REC2, cùng với vùng PI trong vùng WED. ISDra2 TnpB và SpuFz1 có trọng lượng phân tử nhỏ hơn và chứa vùng REC và WED với kích thước nhỏ hơn. Ngược lại, khi so sánh với vùng lặp crRNA, ωRNA của ISDra2 TnpB và SpuFz1 có cấu trúc lớn và phức tạp, thay thế chức năng của một số vùng trên Cas12a, đây có thể là dấu hiệu của sự tiến hoá giữa hai vùng kể trên (hình 2).
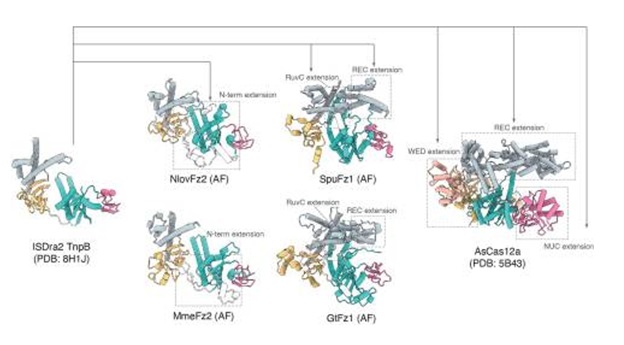
Hình 2. Tổng quan về cấu trúc và phân tích so sánh các protein Fz đại diện. So sánh cấu trúc giữa TnpB, Fz1, Fz2 và Cas12a. Fz1 và Fz2 được cấu trúc từ AlphaFold. Các vùng mở rộng trong nhóm SpuFz1 và GtFz1 có liên quan tới vùng REC và RuvC, tạo thành một kênh tương tự như ở Cas12a.
Đứng trên quan điểm của công nghệ sinh học, Fz có nguồn gốc từ tế bào nhân thực với kích thước tương đối nhỏ so với Cas9/12 phản ánh quá trình tiến hoá tự nhiên, khiến Fz trở thành đề tài lớn cần được khám phá. Bên cạnh đó, Fz còn có chức năng chuyển vị DNA (transposon) do đó Fz có thể đã tiến hoá để có hoạt tính thấp hơn khi so với CRISPR-Cas hoặc được điều hoà bởi chặt chẽ trong cơ thể sinh vật nhằm ngăn ngừa khả năng gây hại tới vật chủ.
Như vậy, nhóm nghiên cứu tại MIT đã xác định và mô tả đặc điểm của Fz như một loại enzym cắt DNA với RNA dẫn đường, qua đó thể hiện mức độ phổ biến của cơ chế nhắm tới DNA mục tiêu qua RNA dẫn đường xuyên suốt giữa tế bào nhân sơ và tế bào nhân thực. Bên cạnh đó, nhóm nghiên cứu cũng đưa ra phương pháp tối ưu trong chỉnh sửa hệ gen bằng Fz, hiện nhóm vẫn đang tiếp tục đưa ra những báo cáo mới nhất về độ đa dạng, đặc điểm sinh hoá và hoạt động của Fz trên chỉnh sửa hệ gen người. Bên cạnh đó, vẫn còn những vấn đề chưa được làm rõ như cơ chế di chuyển của Fz và cơ chế cắt của Fz với những đoạn DNA ngoài mục tiêu, và vai trò của Fz trong chuyển vị trí DNA. Những nghiên cứu sâu hơn về cấu trúc, chức năng của Fz ẩn chứa một tiềm năng vô cùng lớn cho công nghệ chỉnh sửa gen cũng như các công nghệ khác trong tương lai bên cạnh chèn/cắt đoạn DNA.
TÀI LIỆU THAM KHẢO
1. H. Yang, D.J. Patel (2023), “Fanzors: Striking expansion of RNA-guided endonucleases to eukaryotes”, Cell Research, pp.1-2, DOI: 10.1038/s41422-023-00894-0.
2. M. Saito, P. Xu, G. Faure, S. Maguire, et al. (2023), “Fanzor is a eukaryotic programmable RNA-guided endonuclease”, Nature, 620(7974), pp.660-668, DOI: 10.1038/s41586-023-06356-2.