Tế bào gốc là gì?
Tế bào gốc (stem cell) là các tế bào sinh học có khả năng biệt hoá thành các tế bào khác, từ đó phân bào để tạo ra nhiều tế bào gốc hơn. Đây là thuật ngữ dùng để chỉ các tế bào chưa biệt hoá đảm nhiệm chức năng, vai trò cụ thể mà chúng vốn có "số phận" phải phát triển thành. Chẳng hạn, một tế bào xương chỉ có thể sinh ra từ tế bào gốc chứ không thể được sinh ra từ tế bào xương khác. Tế bào gốc có tiềm năng hình thành nên bất kỳ loại tế bào nào mà mình mong muốn. Trong cơ thể, có thể lấy tế bào gốc từ hai nguồn chính, đó là mô cơ thể trưởng thành và phôi giai đoạn sớm. Ngoài ra, các nhà khoa học cũng đã nghiên cứu ra phương thức phát triển tế bào gốc từ các tế bào khác bằng kỹ thuật “lập trình lại gen”. Có hai loại tế bào gốc: tế bào gốc phôi (embryonic stem cell) - phân lập từ phôi nang giai đoạn sớm, và tế bào gốc trưởng thành (adult stem cell) - có trong các mô khác nhau. Trong cơ thể trưởng thành, tế bào gốc và các tế bào tiền thân đóng vai trò như một hệ thống sửa chữa, chúng thay thế và bổ sung các tế bào đã bị lão hoá hoặc hư hỏng ở người trưởng thành. Trong giai đoạn phôi, tế bào gốc có thể biệt hoá thành các tế bào chuyên biệt nhưng cũng duy trì số lượng tế bào của các cơ quan tái tạo, chẳng hạn như máu, da, hoặc các mô đường tiêu hóa.
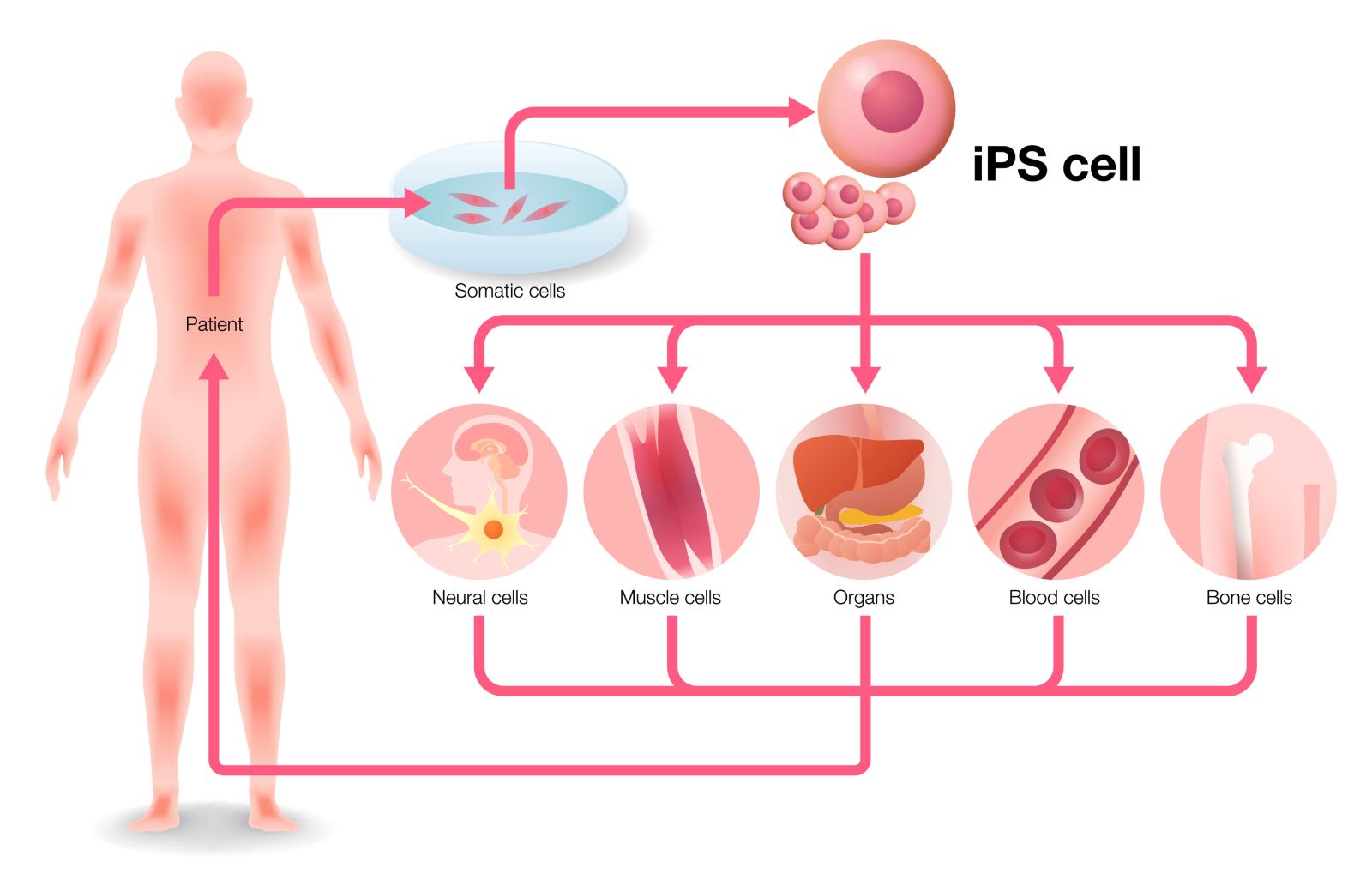
Ở người, có ba nguồn tế bào gốc trưởng thành có khả năng sinh ra thế hệ tế bào sau giống như nó (autologous), đó là: tủy xương, mô mỡ và máu. Tế bào gốc cũng có thể được lấy từ máu dây rốn ngay sau khi sinh hay từ răng sữa hoặc một số mô khác nữa. Trong tất cả các loại tế bào gốc, việc sử dụng tế bào gốc tự thân có ít nguy cơ rủi ro nhất nên được áp dụng rộng rãi nhất. Tế bào gốc trưởng thành thường được sử dụng trong các liệu pháp y khoa khác nhau, chẳng hạn như ghép tủy. Tế bào gốc có thể được phát triển nhân tạo và biệt hoá thành các tế bào chuyên biệt với các đặc tính phù hợp với các tế bào của các mô khác nhau. Các dòng tế bào phôi và các tế bào gốc cảm ứng được tạo ra thông qua việc chuyển gen trong nhân (somatic cell nuclear transfer) hoặc biệt hoá ngược (dedifferentiation) - đó là những phương pháp trị liệu rất tiềm năng trong tương lai.
Những nghiên cứu đầu tiên về tế bào gốc được tiến hành từ những phát hiện của Ernest A. McCulloch và James E. Till tại Đại học Toronto, Canada từ những năm 1960. Cho tới nay, việc nghiên cứu tế bào gốc đã được phát triển rầm rộ ở khắp các quốc gia trên thế giới và những thành quả về ứng dụng tế bào gốc trong điều trị bệnh luôn được cập nhật với những thành quả bất ngờ. Vậy tại sao tế bào gốc lại đảm nhiệm được các nhiệm vụ này? Chúng ta hãy lướt qua các tính chất của tế bào gốc. Theo định nghĩa kinh điển, một tế bào gốc phải có đầy đủ 2 yếu tố sau: một là tự làm mới (self-renewal) - khả năng này xuyên suốt các chu kỳ sinh sản tế bào, nhưng vẫn giữ được tình trạng không biệt hoá; hai là tiềm năng biệt hoá thành các dạng tế bào chuyên biệt - khả năng này đòi hỏi tế bào gốc phải là totipotent (toàn năng) hay pluripotent (vạn năng) để có khả năng tạo ra bất kỳ dạng tế bào trưởng thành nào. Tế bào tiền thân multipotent (đa năng) hay unipotent thỉnh thoảng cũng được xem như là tế bào gốc. Việc tự làm mới được thực hiện bởi cơ chế sao chép bất đối bắt buộc (Obligatory asymmetric replication) và cơ chế biệt hóa ngẫu nhiên (Stochastic differentiation).
Tiềm năng và ứng dụng của tế bào gốc
Tiềm năng (potency) là khả năng biệt hoá tế bào của tế bào gốc. Trong đó, các tế bào totipotent (toàn năng) có khả năng biệt hoá thành các dạng tế bào phôi và ngoài phôi. Các tế bào gốc pruripotent (vạn năng) là hậu duệ của tế bào gốc totipotent và có khả năng biệt hoá thành các tế bào xuất phát từ bất kỳ lớp mầm nào trong 3 lớp mầm Endoderm (nội bì), Mesoderm (trung bì) và Ectoderm (ngoại bì). Các tế bào gốc multipotent (đa năng) có khả năng tạo ra duy nhất các tế bào cùng họ với tế bào đó (như tế bào gốc tạo máu thì có khả năng biệt hoá thành hồng cầu, bạch cầu, tiểu cầu…). Các tế bào gốc oligopotent (đơn năng) có thể biệt hóa thành một số loại tế bào, chẳng hạn như các tế bào gốc lymphoid hoặc tủy xương. Các tế bào gốc unipotent có khả năng tạo ra duy nhất một loại tế bào nhưng vẫn có tính chất tự làm mới, đây là điểm phân biệt với tế bào không phải tế bào gốc (chẳng hạn như tế bào gốc cơ).
Ứng dụng tế bào gốc trong điều trị bệnh
Cấy ghép tủy xương là một liệu pháp tế bào gốc đã được sử dụng trong nhiều năm mà không có bất kỳ tranh cãi nào. Không có liệu pháp tế bào gốc nào ngoài ghép tủy xương được sử dụng rộng rãi như vậy. Ưu điểm của liệu pháp này là làm giảm các triệu chứng có thể cho phép bệnh nhân giảm lượng thuốc trong điều trị bệnh. Việc điều trị bằng tế bào gốc cũng góp phần cung cấp kiến thức và hiểu biết về tế bào, đồng thời mở ra các hướng điều trị mới trong tương lai. Nhược điểm của liệu pháp là: việc điều trị tế bào gốc có thể cần đến sự ức chế miễn dịch do cần chiếu xạ trước khi cấy ghép để loại bỏ các tế bào trước đó của bệnh nhân, hoặc do hệ thống miễn dịch của bệnh nhân có thể tấn công các tế bào gốc. Một cách tiếp cận để tránh thải loại cấy ghép là sử dụng các tế bào gốc từ chính bệnh nhân đang được điều trị. Ngoài ra, tính đa năng trong các tế bào gốc cũng gây khó khăn trong việc biệt hoá thành một loại tế bào cụ thể. Rất khó để thu được chính xác loại tế bào cần thiết sau quá trình biệt hoá, bởi không phải tất cả các tế bào trong một quần thể đều biệt hoá một cách thống nhất. Các tế bào không biệt hoá có thể tạo các mô nhưng không tạo thành các loại tế bào mong muốn. Một số tế bào gốc hình thành các khối u sau khi nuôi cấy (sự đa năng có liên quan đến sự hình thành khối u); đặc biệt trong tế bào gốc phôi thai, các tế bào gốc cảm ứng iPSC.
Cho tới nay, tế bào gốc đã được ứng dụng trong việc điều trị các bệnh sau: tiểu đường, viêm đa khớp, Parkinson, Alzheimer, viêm xương khớp, tai biến mạch máu não và chấn thương sọ não, khuyết tật do rối loạn bẩm sinh, tổn thương tủy sống, nhồi máu cơ tim, trị liệu ung thư, hói, thay thế răng bị mất, hạn chế thính giác, phục hồi thị lực và sửa chữa hư hỏng cho giác mạc, xơ cứng động mạch, bệnh Crohn, chữa lành vết thương, chữa vô sinh do thiếu tế bào gốc tinh trùng. Ngoài ra, nhiều nghiên cứu đang được tiến hành nhằm phát triển các nguồn tế bào gốc khác nhau, cũng như áp dụng các phương pháp điều trị cho các bệnh thoái hoá thần kinh, tiểu đường, tim mạch và các bệnh lý khác. Một số nghiên cứu thì đang tạo ra các tổ chức siêu nhỏ (organoids) nhờ sử dụng các tế bào gốc, điều này giúp chúng ta hiểu rõ hơn về sự phát triển của con người, sự hình thành cơ thể và mô hình hóa các bệnh trên người.
Nhiễm độc gan và tổn thương gan gây ra do thuốc là nguyên nhân chiếm tỷ lệ đáng kể trong các thất bại của việc thử nghiệm thuốc mới. Điều này làm nổi bật sự cần thiết của việc sử dụng tế bào gốc để biệt hoá thành các tế bào gan có khả năng phát hiện độc tính sớm trong quá trình phát triển thuốc.
Tế bào gốc cảm ứng iPSC
Trong những năm gần đây, sự phát triển của khoa học đã mang lại thành công trong việc phân lập và tạo ra các tế bào gốc phôi thai, cũng như tạo ra các tế bào gốc bằng cách chuyển nhân tế bào soma hay các kỹ thuật tạo ra các tế bào gốc cảm ứng iPSC. Khi nghĩ về tế bào gốc và y học, hầu hết mọi người ngay lập tức hình dung rằng tế bào gốc và các tế bào được biệt hóa từ chúng sẽ được dùng cho cấy ghép. Tuy nhiên, tầm ảnh hưởng của của iPSC còn vượt xa hơn liệu pháp tế bào hay các ứng dụng khác, vì iPSC hiện nay lại có thêm một ứng dụng y sinh học tuyệt vời là mô hình hóa bệnh lý. Với tính năng này, các nhà khoa học có thể thử nghiệm nhiều phương thức trị liệu khác nhau trong phòng thí nghiệm mà không cần phải tiến hành thử nghiệm trên cơ thể con người. Đây là một ưu điểm cực kỳ quan trọng vì nếu làm thực nghiệm trên người thì bắt buộc phải tuân thủ những quy định rất khắt khe và thường liên lụy tới các vấn đề thuộc đạo đức hết sức phức tạp và khó vượt qua. Khi sử dụng iPSC thì những vướng mắc này dễ dàng vượt qua được, điều đó giúp cho các nhà khoa học có những khám phá nhanh chóng hơn rất nhiều so với việc thực hiện trực tiếp trên bệnh nhân. Theo cách này, các nhà nghiên cứu có mô hình sống cho các loại bệnh trong đĩa nuôi cấy để nghiên cứu chúng một cách trực tiếp và hoàn toàn mới, vốn chưa từng được thực hiện trước đó. Chẳng hạn, từ các tế bào iPSC, các nhà khoa học có thể tạo ra được nhiều tế bào cơ tim với việc bắt đầu từ tế bào da của bệnh nhân bị bệnh tim. Đó chỉ là một ví dụ đơn giản về iPSC. Với những ứng dụng này, tế bào iPSC sẽ có những ảnh hưởng lớn trong y học, cho dù chúng chưa được chấp thuận chính thức ứng dụng trong lâm sàng.
Hiện trạng ứng dụng tế bào gốc tại Việt Nam
Việc ứng dụng tế bào gốc trong điều trị bệnh tại Việt Nam rất đa dạng. Trước hết, phải thừa nhận rằng việc ghép tế bào gốc tạo máu (ghép tủy) đã cứu sống được rất nhiều bệnh nhân. Hàng nghìn người bị ung thư máu - căn bệnh hiểm nghèo xưa nay thì hiện tại đã được tế bào gốc cứu sống. Hàng ngày có hàng chục, thậm chí hàng trăm bệnh nhân ung thư máu đã được ghép tế bào gốc ở khắp các viện huyết học truyền máu, các bệnh viện quân và dân y trên toàn quốc, điều đó cũng có nghĩa là từng ấy người đã được cứu sống hàng ngày. Ứng dụng rộng rãi thứ hai về tế bào gốc là sử dụng tế bào gốc mô mỡ tự thân chữa thoái hóa khớp gối. Cho tới nay đã có hàng trăm bệnh nhân được chữa khỏi thoái hóa khớp gối, chất lượng cuộc sống được nâng cao rõ rệt.
Ghép tế bào gốc cho bệnh nhân xơ gan ở Việt Nam.
Bệnh phổi tắc nghẽn mạn tính (COPD) cũng đang được thử nghiệm lâm sàng với cấp độ nhà nước, kết quả ban đầu khá khả quan. Đây là một bệnh khó, nếu trị liệu thành công sẽ mang lại rất nhiều lợi ích cho người bệnh và xã hội nói chung.
Bệnh bại não gần đây cũng được báo cáo là chữa được bằng tế bào gốc tự thân. Đây cũng là bệnh khó, rất khó. Nếu thành công sẽ mang lại hạnh phúc cho nhiều người.
Tế bào gốc cũng được sử dụng để chữa bệnh liệt tủy do tai nạn giao thông. Những kết quả ban đầu cũng rất đáng khích lệ.
Tự kỷ là một bệnh vô cùng khó, thế nhưng những kết quả ban đầu điều trị bằng tế bào gốc đã đem đến cho chúng ta những kỳ vọng to lớn trong việc điều trị căn bệnh này.
Bệnh đái tháo đường giờ đây cũng được điều trị bằng tế bào gốc và theo số liệu ban đầu cũng đầy triển vọng.
Có những bệnh rất hiếm như bệnh ly thượng bì ở trẻ em, thường gây tử vong rất lớn do nhiễm trùng, thế mà chính Việt Nam lại là nơi chữa trị thành công và nhiều nước bạn đang muốn học hỏi, chia sẻ…
Nhìn chung, tuy còn nghèo về cơ sở vật chất, cán bộ chuyên sâu còn ít nhưng chúng ta đã làm được những việc mà thế giới cũng phải thán phục. Đó là những ưu điểm của việc sử dụng tế bào gốc. Vậy việc sử dụng tế bào gốc có thực sự là tốt lành hết không? Chúng ta hãy điểm qua vài nét trong phân tích sau đây.
Một số vấn đề trong ứng dụng tế bào gốc
Bên cạnh những tiềm năng to lớn và kết quả tuyệt vời trong việc ứng dụng tế bào gốc điều trị bệnh, vẫn còn có những cuộc tranh luận xung quanh các vấn đề về đạo đức và chính trị. Hiện nay, việc sử dụng tế bào gốc dây rốn đang nhận được sự quan tâm rất lớn của cộng đồng. Vậy thực hư vấn đề này thế nào?
Ngày 20/2/2010, phát biểu tại Hội nghị thường niên Hiệp hội vì sự tiến bộ của khoa học Hoa Kỳ (AAAS), Irving Weissman, Giám đốc Viện Y học phục hồi và tế bào gốc sinh học, thuộc Đại học Stanford - California, Hoa Kỳ cho biết: dây rốn chứa các tế bào gốc có thể duy trì khả năng tạo máu ở mức độ chỉ cho trẻ nhỏ. Mặc dù "khả năng chữa bệnh của tế bào gốc dây rốn chưa hề được chứng minh" nhưng hiện tại nó lại rất thịnh hành ở nhiều nước có quy định lỏng lẻo trong ngành y tế. Weissman cho rằng, các bệnh viện tư đang "kiếm tiền" từ những người tin vào khả năng kỳ kiệu của tế bào gốc lấy từ dây rốn.
Mối liên quan giữa tế bào gốc và ung thư
Điều mà chúng ta nên thận trọng là khi cơ thể có quá ít tế bào gốc thì sẽ dẫn tới lão hóa và bệnh tật. Tuy nhiên, dù có tuyệt vời như thế nào đi nữa thì nhiều tế bào gốc quá đôi khi cũng không tốt. Tế bào gốc có thể gây ra ung thư và trong một số trường hợp, chúng còn tạo ra dạng ung thư đặc biệt khó chữa. Khi bị tổn hại, tế bào gốc của chúng ta có thể biến đổi thành một dạng tế bào gốc rất nguy hiểm, đó là “tế bào gốc ung thư” (cancer stem cell) mà sau đó biết đâu sẽ hình thành nên khối u. Một tế bào gốc ung thư là một tế bào đơn lẻ có khả năng đặc biệt để hình thành một khối u hoàn toàn mới. Một tế bào gốc ung thư mang nhiều quyền năng của tế bào gốc nhưng lại không nằm dưới sự điều khiển của các nhân tố thông thường vốn giúp chúng định hướng và kiểm soát những quyền năng đó. Chúng chẳng khác gì một chiếc xe đua không phanh kiểu đua Công thức 1. Mối liên hệ giữa tế bào gốc và ung thư là đặc biệt quan trọng ở nhiều khía cạnh. Điều mà chúng ta cần phải xem xét đó là những điểm giống nhau và khác nhau giữa tế bào gốc bình thường và tế bào gốc ung thư.
Những nguyên nhân dẫn đến ung thư có thể giúp chúng ta kiểm soát được tế bào gốc cũng như ứng dụng những tiềm năng của chúng trong lâm sàng. Chẳng hạn, ở tế bào gốc nội sinh thì thời gian để một tổn thương xảy ra là nhiều năm hay nhiều thập kỷ, nhưng ở tế bào gốc nuôi cấy trong phòng thí nghiệm thì thời gian diễn ra rút ngắn hơn rất nhiều, có thể chỉ vài tuần. Bởi một nguyên do là khi một tế bào gốc được nuôi cấy và chuẩn bị cho cấy ghép thì nhiều sai hỏng nghiêm trọng thỉnh thoảng xảy ra trong hệ gen (do đột biến) làm chúng có khuynh hướng hoạt động như tế bào ung thư. Tế bào gốc mang nhiều sai hỏng từ phòng thí nghiệm là những rào cản lớn khiến cho việc cấy ghép tế bào gốc chưa thể thành một công cụ thông dụng của các bác sĩ.
Ngược lại, các tế bào gốc nội sinh được lưu giữ trong chính cơ thể nên chúng được bảo vệ an toàn hơn. Đặc biệt, lối sống của mỗi người có thể giúp giảm thiểu những ảnh hưởng của môi trường bên ngoài lên tế bào gốc. Tế bào gốc nội sinh còn được kiểm soát chặt chẽ bởi các tế bào khác và môi trường cơ thể. Chính những tương tác này sẽ định hướng cho chúng biết chính xác việc gì cần phải làm.
Những bài học từ liệu pháp gen
Lịch sử và kinh nghiệm từ những thành công trong việc cấy ghép tủy xương đã đem đến cho liệu pháp tế bào gốc nhiều bài học quý giá. Tuy vậy, trong lĩnh vực công nghệ sinh học cũng có những bài học vô cùng đau xót. Một ví dụ rất đáng sợ mà chúng ta bắt buộc phải nhắc lại để cảnh giác, đó là sự kiện xảy ra vào đầu những năm 1990. Khi đó, liệu pháp gen được coi là một phương pháp y khoa quyền năng đã đi chệch hướng một cách thảm khốc, ít nhất chỉ vì sự phát triển quá nhanh. Sự hấp tấp cùng với việc thiếu kiến thức, khi mà liệu pháp gen là quá mới đã làm cho một số bệnh nhân tử vong, trong đó điển hình nhất là trường hợp của Jesse Gelsinger. Sau khi nguyên nhân tử vong được xác định là do liệu pháp gen, một cơn bão truyền thông đã nổi lên. Bài báo với tiêu đề “Chết vì công nghệ sinh học, trường hợp của Jesse Gelsinger” đăng trên New York Times là một trong vô vàn bài báo liên quan. Do dư luận phản ứng quá dữ dội đã làm lĩnh vực này đóng băng một thời gian dài sau đó mới từ từ phục hồi.
Cũng như rất nhiều vấn đề trong cuộc sống, không phải cứ có bệnh là chúng ta ra nước ngoài để sử dụng tế bào gốc. Câu chuyện này không hề đơn giản: có nhiều rào cản khiến cho việc điều trị bằng tế bào gốc một cách an toàn và hiệu quả khó thành hiện thực. Những tác dụng phụ và nguy cơ nghiêm trọng từ liệu pháp tế bào gốc đã được lưu ý. Việc nhận định và hiểu đúng những thách thức và rào cản đó là vô cùng quan trọng. Việc lờ đi những rào cản chính là nguyên nhân của những thảm họa. Để trở thành một chuyên gia về tế bào gốc thực thụ, chúng ta nên biết cả những mặt mạnh và yếu của liệu pháp này. Chúng ta cần xem xét mọi yếu tố then chốt của tế bào gốc, cả tốt lẫn xấu để thực hiện được mục tiêu chính là hiệu quả và an toàn.
Có một điều rất quan trọng là, khi cấy ghép tế bào gốc tự thân vẫn có thể nảy sinh các vấn đề về miễn dịch. Do đó, kể cả khi bệnh nhân được ghép bằng chính tế bào của mình thì cơ thể người này vẫn coi những tế bào đó là ngoại lai và tiêu diệt chúng. Tại sao vậy? Đó chính là phản ứng tự miễn. Vậy thì đừng bao giờ chủ quan khi cấy ghép tự thân, đặc biệt là sốc phản vệ có thể gây chết người. Bài học này sẽ còn lưu truyền mãi mãi.
x
x x
Mặc dù tế bào gốc có nhiều triển vọng trong ứng dụng y học và theo lý thuyết là giải pháp mới trong tương lai. Nhưng nhìn chung, chúng ta mới chỉ loanh quanh ở giai đoạn khởi đầu của cuộc cách mạng tế bào gốc. Dĩ nhiên, liệu pháp này cũng gặp không ít các vấn đề liên quan đến pháp lý. Hơn nữa, mọi thứ đều có thể bị thổi phồng và con người có thể bị lợi dụng hoặc bị tổn thương về thể xác. Vậy làm thế nào để vấn đề này đi đúng hướng? Hoa Kỳ là nước tiên phong đưa ra các luật định về tế bào gốc mà cơ quan có thẩm quyền là FDA. Một câu hỏi được đặt ra là, ở Việt Nam chúng ta theo đạo luật nào? Tiếc rằng câu hỏi này vẫn còn bỏ ngỏ. Đó cũng là nguyên nhân của việc các trung tâm chữa trị bằng tế bào gốc đang phát triển một cách tự phát, thiếu kiểm soát.
Ở đây nổi lên một vấn đề là vai trò của nhà quản lý. Sự lơ là trong quản lý sẽ gây ra những thảm họa khôn lường. Nhưng nếu quá chặt chẽ, khắt khe lại bóp chết một ngành khoa học đầy tiềm năng mà chưa được khai phá.
TÀI LIỆU THAM KHẢO
1. A.J. Becker, E.A. McCulloch, J.E. Till (1963), “Cytological demonstration of the clonal nature of spleen colonies derived from transplanted mouse marrow cells”, Nature, 197, pp.452-454, Doi: 10.1038/197452a0.
2. I.L. Weissman, J.A. Shizuru (2008), “The origins of the identification and isolation of hematopoietic stem cells, and their capability to induce donor-specific transplantation tolerance and treat autoimmune diseases”, Blood, 112, pp.3543-3553, Doi: 10.1182/blood-2008-08-078220.
3. I. Bisson, E. Green, M. Sharpe, C. Herbert, J. Hyllner, N. Mount (2015), “Landscape of current and emerging cell therapy clinical trials in the UK: current status, comparison to global trends and future perspectives”, Regen. Med., 10, pp.169-179, Doi: 10.2217/rme.14.71.
4. S.L. Maude, et al. (2014), “Chimeric antigen receptor T cells for sustained remissions in leukemia”, N. Engl. J. Med., 371, pp.1507-1517, Doi: 10.1056/NEJMoa1407222.
5. M. Cavazzana-Calvo, et al. (2000), “Gene therapy of human severe combined immunodeficiency (SCID)-X1 disease”, Science, 288, pp.669-672, Doi: 10.1126/science.288.5466.669.
6. M. Brittberg, A. Lindahl, A. Nilsson, C. Ohlsson, O. Isaksson, L. Peterson (1994), “Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation”, N. Engl. J. Med., 331, pp.889-895, Doi: 10.1056/NEJM199410063311401.
7. H. Green, O. Kehinde, J. Thomas (1979), “Growth of cultured human epidermal cells into multiple epithelia suitable for grafting”, Proc. Natl. Acad. Sci. USA, 76, pp.5665-5668, Doi: 10.1073/pnas.76.11.5665.
8. I.L. Weissman (2000), “Translating stem and progenitor cell biology to the clinic: barriers and opportunities”, Science, 287, pp.1442-1446, Doi: 10.1126/science.287.5457.1442.
9. J.C. Garbern, R.T. Lee (2013), “Cardiac stem cell therapy and the promise of heart regeneration”, Cell Stem Cell, 12, pp.689-698, Doi: 10.1016/j.stem.2013.05.008.
10. L. Stevanato, R.L. Corteling, P. Stroemer, A. Hope, J. Heward, E.A. Miljan, J.D. Sinden (2009), “c-MycERTAM transgene silencing in a genetically modified human neural stem cell line implanted into MCAo rodent brain”, BMC Neurosci., 10, Doi: 10.1186/1471-2202-10-86.
11. Paul Knoepfler (2013), Stem Cells: An Insider's Guide, World Scientific Publishing Co. Pte. Ltd., 368pp, Doi: 10.1142/8821.
12. K. Pollock, et al. (2006), “A conditionally immortal clonal stem cell line from human cortical neuroepithelium for the treatment of ischemic stroke”, Exp. Neurol., 199, pp.143-155, Doi: 10.1016/j.expneurol.2005.12.011.
13. N. Cartier, et al. (2009), “Hematopoietic stem cell gene therapy with a lentiviral vector in X-linked adrenoleukodystrophy”, Science, 326, pp.818-823, Doi: 10.1126/science.1171242.
14. A. Abrate, et al. (2014), “Mesenchymal stem cells expressing therapeutic genes induce autochthonous prostate tumour regression”, Eur. J. Cancer, 50, pp.2478-2488, Doi: 10.1016/j.ejca.2014.06.014.
15. K. Takahashi, S. Yamanaka (2006), “Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors”, Cell, 126, pp.663-676, Doi: 10.1016/j.cell.2006.07.024.
16. K. Takahashi, K. Tanabe, M. Ohnuki, M. Narita, T. Ichisaka, K. Tomoda, S. Yamanaka (2007), “Induction of pluripotent stem cells from adult human fibroblasts by defined factors”, Cell, 131, pp.861-872, Doi: 10.1016/j.cell.2007.11.019.
17. J. Yu, et al. (2007), “Induced pluripotent stem cell lines derived from human somatic cells”, Science, 318, pp.1917-1920, Doi: 10.1126/science.1151526.
18. M. Turner, et al. (2013), “Toward the development of a global induced pluripotent stem cell library”, Cell Stem Cell, 13, pp.382-384, Doi: 10.1016/j.stem.2013.08.003.
19. P.A. Gourraud, L. Gilson, M. Girard, M. Peschanski (2012), “The role of human leukocyte antigen matching in the development of multiethnic ‘haplobank’ of induced pluripotent stem cell lines”, Stem Cells, 30, pp.180-186, Doi: 10.1002/stem.772.