Lịch sử lâu dài
Công nghệ đông khô (Freeze drying hoặc Lyophilization) có một lịch sử rất lâu dài khi vào năm 1250-850 BC., người Inca cổ đại ở Peru đã biết đặt khoai tây và hoa màu của họ lên trên đỉnh Machu Picchu (một thành phố cổ của người Inca, nằm trên một sườn núi cao 2.430 m thuộc dãy núi phía Đông của miền nam Peru) để bảo quản được lâu dài. Lúc đó họ không nhận ra rằng với áp suất thấp trên độ cao lớn đã làm thực phẩm bị rút nước (bốc hơi) và khiến chúng khô đi. Mặc dù quá trình này diễn ra tương đối chậm nhưng chất lượng của thực phẩm vẫn được bảo toàn do trạng thái đông cứng cuối cùng của nó. Điều thú vị là người Viking cũng đông khô thực phẩm yêu thích của họ là cá bằng cách tận dụng khí hậu lạnh và khô của vùng Bắc Âu. Năm 1890, Altman - một nhà khoa học người Đức đã báo cáo rằng có thể thu được mô khô ở áp suất dưới áp suất khí quyển và nhiệt độ xấp xỉ -20oC, và Shackell - nhà khoa học người Mỹ đã khám phá lại kỹ thuật này vào năm 1909 để bảo quản các hoạt chất sinh học. Ông cũng là người đầu tiên nhận ra rằng, sản phẩm phải được đông lạnh trước khi bắt đầu quá trình sấy khô, do đó gọi là đông khô. Năm 1938, cà phê đông khô lần đầu tiên được sản xuất, đánh dấu sự phát triển vượt bậc của thực phẩm dạng bột những năm sau đó. Một điều thú vị là vào năm 1968, Tập đoàn Whirlpool theo hợp đồng với NASA dành cho các chuyến bay Apollo đã phát triển thành công loại kem đông khô, hay còn gọi là kem phi hành gia [1].
Công nghệ đông khô là quy trình loại bỏ nước ra khỏi sản phẩm sau khi nó được đông lạnh và đặt trong môi trường chân không, cho phép nước đá chuyển trực tiếp từ thể rắn sang thể hơi mà không cần qua trung gian là thể lỏng [2].
Trong lĩnh vực dược phẩm, công nghệ đông khô được sử dụng nhằm tối ưu hóa nhiệt độ bảo quản, tăng thời hạn sử dụng cũng như giảm thiểu tác động của nhiệt độ trong quá trình vận chuyển sản phẩm. Phương pháp này lần đầu tiên được áp dụng trên vắc xin phòng bệnh đậu mùa vào năm 1909. Các nhà khoa học đã cố gắng hong các thành phần của vắc xin bằng không khí khô để biến chúng thành dạng bột. Cho tới những năm 40 của thế kỷ XIX, với những tiến bộ trong việc khử nước ra khỏi vắc xin, vắc xin phòng lao (BCG) và vắc xin đậu mùa đã được bào chế ở dạng bột khô đa liều và phân phối đại trà ở nhiều quốc gia. Năm 1950, TS Collier (nhà khoa học người Anh) đã hoàn thiện phương pháp đông khô. Sáng kiến này ban đầu được áp dụng chủ yếu trên vắc xin sử dụng vi rút bất hoạt. Sau đó được điều chỉnh lại để có thể áp dụng cho nhiều loại vắc xin khác với quy mô lớn trong các phòng thí nghiệm trên khắp thế giới. Đây là một bước tiến rất quan trọng cho việc mở rộng tiêm chủng vì vắc xin trước đó vẫn cần được bảo quản lạnh [1].
Triển vọng đơn giản hóa quy trình bảo quản vắc xin
Hiện nay, đại dịch COVID-19 ở Việt Nam đã là làn sóng lây nhiễm thứ 4, kể từ tháng 2/2020. Trong bối cảnh dịch bệnh còn tiếp tục gia tăng, việc sử dụng vắc xin để ngăn chặn mạnh mẽ hơn quá trình lây nhiễm là rất cần thiết nhằm đạt được miễn dịch cộng đồng. Nếu đặt mục tiêu tiêm vắc xin cho 70% dân số trong năm 2021 thì chúng ta cần tiêm cho khoảng 68,32 triệu người dân, với tổng cộng 136,64 triệu liều (2 liều/người) [3]. Vậy nên yêu cầu về quy trình bảo quản và phân phối vắc xin thật sự không đơn giản. Khó khăn hơn nữa là hầu hết các loại vắc xin đều yêu cầu bảo quản ở nhiệt độ tiêu chuẩn. Ví dụ, mRNA-1273 của Moderna có thể bảo quản ổn định ở -20oC trong 6 tháng, ở 2-8oC trong 30 ngày và 25oC trong tối đa 12 giờ. Vắc xin mRNA Pfizer-BioNTech’s BNT162b2 cần được bảo quản ở -70oC, hạn sử dụng khoảng 6 tháng. Sau khi vắc xin được rã đông, nó có thể được bảo quản ở 2-8oC trong 5 ngày và chỉ 2 giờ với nhiệt độ phòng. Vắc xin AstraZeneca-Oxford’s AZD1222 (hay ChAdOx1-S) có thời hạn sử dụng 6 tháng ở 2-8oC và trong 6 giờ sau khi mở nắp ở nhiệt độ phòng [4]… Điều này đang khiến cho kế hoạch triển khai tiêm chủng vắc xin phòng COVID-19 của nhiều quốc gia càng trở nên khó khăn, không chỉ riêng Việt Nam, khi phần lớn chưa có hoặc không đủ thiết bị bảo quản, vận chuyển chuyên dụng như kho lạnh âm sâu, hộp lạnh.... Ngay cả tại Mỹ - nơi 2 loại vắc xin Pfizer-BioNTech và Moderna được sản xuất cũng gặp nhiều trở ngại khi đưa vào tiêm chủng rộng rãi trong cộng đồng.
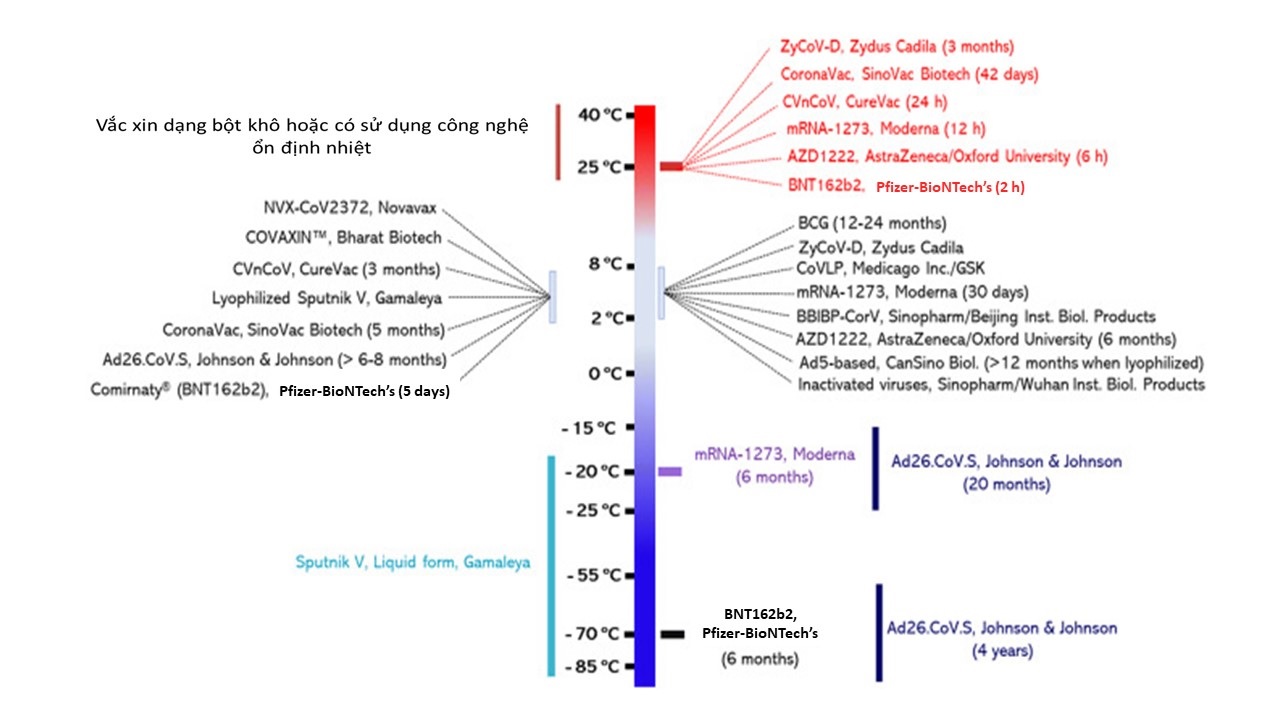
Nhiệt độ bảo quản yêu cầu ở các dạng khác nhau của một số loại vắc xin COVID-19 hiện nay (day: ngày; month: tháng; year: năm, h: giờ; lyophilized: đông khô hóa).
(Nguồn: www.ncbi.nlm.nih.gov).
Hiểu rõ những điểm yếu trên, các hãng sản xuất vắc xin lớn vẫn đang chạy đua trong việc ứng dụng nhiều công nghệ khác nhau nhằm “bột hóa” chế phẩm, qua đó đảm bảo thuận tiện cho quá trình bảo quản và phân phối vắc xin. Trong đó, công nghệ đông khô cũng đang được thử nghiệm liên tục. Pfizer và BioNTech đã bắt đầu thử nghiệm giai đoạn 3 nhằm đánh giá hiệu quả vắc xin COVID-19 của họ ở dạng đông khô. Chế phẩm này là một lọ có tiêu chuẩn tương đương với một liều vắc xin ở dạng lỏng, sau đó thành phần bên trong được đông khô thành bột. Vắc xin ở dạng bột được cho là ổn định hơn so với dạng lỏng và sẽ được bảo quản ở 2-8oC. Trước khi tiêm, bột được hoàn nguyên bằng cách hòa tan với dung dịch pha (dung môi). Dự kiến thử nghiệm này sẽ có kết quả vào cuối năm 2021 [5]. Ngoài ra, một tân binh khác là Arcturus Therapeutics (Công ty công nghệ sinh học chuyên về dược phẩm mRNA đến từ Mỹ) cũng đã tiến hành các thử nghiệm giai đoạn 1 và 2 ở Singapore đối với vắc xin COVID-19 (ARCT-021) của họ. Kết quả cho thấy triển vọng đầy hứa hẹn về tính an toàn lẫn khả năng sinh miễn dịch với chỉ một liều duy nhất. Hiện tại, vắc xin đông khô của hãng cũng đang được thử nghiệm giai đoạn 3 ở một số nơi, trong đó có Việt Nam [6].
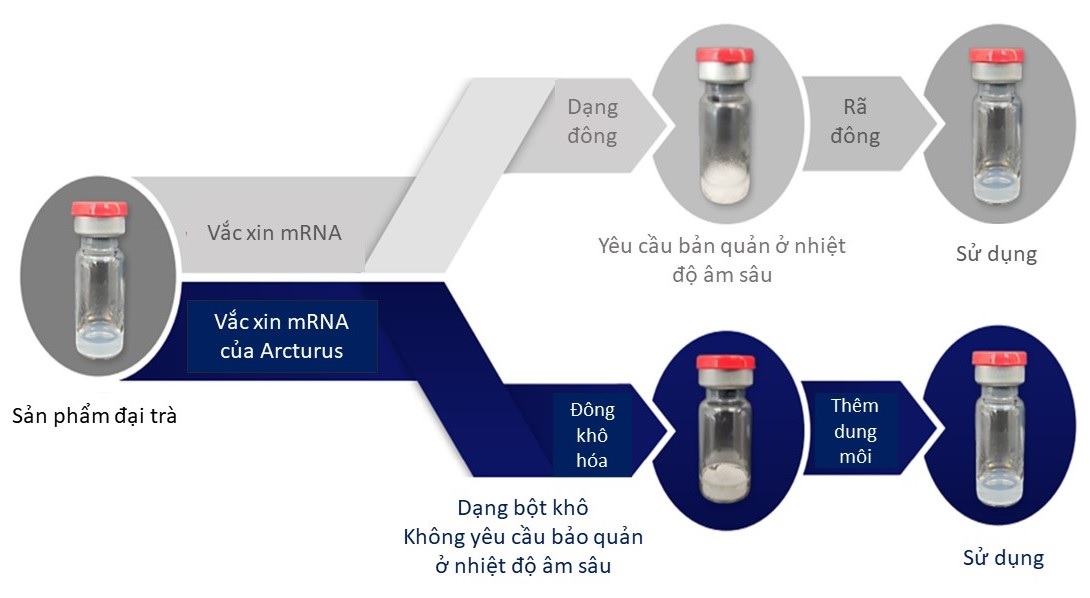
Sản phẩm vắc xin đông khô của hãng Arcturus Therapeutics.
(Nguồn: ir.arcturusrx.com)
Một vấn đề cần lưu tâm là liệu chất lượng của các thành phần có trong vắc xin COVID-19 có được đảm bảo sau khi trải qua chu trình đông khô không? Hiện tại có khá ít dữ liệu được công bố về vần đề này. Ví dụ như trường hợp của vắc xin sử dụng công nghệ mRNA. Thành phần của chúng thường là các sợi axit ribonucleic thông tin (mRNA) được đóng gói trong các hạt nano lipid (LNP) nhằm ổn định cấu trúc của mRNA. Vắc xin dạng này được hấp thu dễ dàng vào tế bào bên trong cơ thể, qua đó tạo được miễn dịch hiệu quả hơn. Trước đây, một vài nghiên cứu rải rác đã chỉ ra mRNA đông khô ổn định ở 4oC trong 10 tháng [7]. Các hạt nano lipid cũng có thể đông khô thành công. Trong quá trình đông khô, các thành phần của vắc xin sẽ trải qua các áp suất khác nhau, cần các chất bảo vệ (được gọi là lyoprotecter) giúp ổn định các thành phần này. Các nghiên cứu với mRNA hoặc với LNPs đã cho thấy, đông khô có thể là một giải pháp khả thi để tăng tính ổn định của liên kết mRNA-LNP. Tuy nhiên, một báo cáo gần đây (2021) về mRNA-LNP lại phát hiện là sau khi đông khô và hoàn nguyên thì hiệu quả in vivo của chế phẩm bị mất đi [8]. Ngoài ra, còn có những trở ngại khác như quy trình công nghệ dùng cho vắc xin tương đối phức tạp, tăng các khoản chi phí và chuỗi cung ứng bị đứt gãy trong thời kỳ dịch bệnh. Do đó, chúng ta vẫn phải đợi những kết quả chi tiết từ những nghiên cứu uy tín hơn nữa thì mới có được kết luận về hiệu quả của công nghệ đông khô đối với vắc xin COVID-19.
Thay lời kết
Trái ngược với hầu hết các dự đoán ban đầu về thời gian kết thúc, COVID-19 vẫn đang hoành hành trên toàn cầu và chưa có dấu hiệu dừng lại. Hiện tại, vắc xin vẫn là giải pháp hữu hiệu nhất để chống lại dịch bệnh. Tuy vậy, ngoài giới hạn về số lượng sản xuất, các yêu cầu nghiêm ngặt về quy trình bảo quản với nhiệt độ âm sâu đã và đang là rào cản đối với việc đẩy nhanh phân phối và tiêm chủng vắc xin cho người dân, nhất là ở các cộng đồng kém phát triển. Do vậy, sử dụng các công nghệ hiện có để biến đổi vắc xin thành dạng bột khô có thể bảo quản ở nhiệt độ cao hơn là thật sự cần thiết. Tuy nhiên, việc ứng dụng công nghệ này trong sản xuất vắc xin COVID-19 vẫn còn nhiều khó khăn cần phải giải quyết, nhất là bài toán đảm bảo tính toàn vẹn của các thành phần cũng như hiệu quả miễn dịch tạo ra sau chủng ngừa. Cuối cùng, xin được nhắc lại câu nói của PGS.TS Jason L. Schwartz (Trường Y tế Công cộng, Đại học Yale, Mỹ): “Ngay cả khi một loại vắc xin chỉ có hiệu quả 50% trong việc ngăn ngừa bệnh cũng có thể dập tắt đại dịch nếu như nó được phân phối đủ nhanh”.
TÀI LIỆU THAM KHẢO
[1] Dushyant Varshney, Manmohan Singh (2015), “Lyophilized biologics and vaccines modality-based approaches”, Springer New York Heidelberg Dordrecht London, pp.3-7, DOI: 10.1007/978-1-4939-2383-0.
[2] https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/inspection-guides/lyophilization-parenteral-793.
[3] https://www.qdnd.vn/tren-tuyen-dau-chong-dich/cac-van-de/tinh-hinh-san-xuat-vaccine-dat-hang-mua-phan-phoi-vaccine-phong-covid-19-tren-the-gioi-va-giai-phap-cua-viet-nam-hien-nay-664486.
[4] Khaled AboulFotouh, Zhengrong Cui, Robert O. Williams (2021), “Next-generation COVID-19 vaccines should take efficiency of distribution into consideration”, AAPS Pharm. Sci. Tech., 22(126), pp.1-15.
[5] https://www.pfizer.com/science/coronavirus/vaccine/studies-address-new-formulations.
[6] https://ir.arcturusrx.com/news-releases/news-release-details/arcturus-therapeutics-announces-positive-interim-arct-021-lunar.
[7] Pengxuan Zhao, Xucheng Hou, Jingyue Yan, Shi Du, Yonger Xue, Wenqing Li, Guangya Xiang, Yizhou Dong (2020), “Long-term storage of lipid-like nano particles form RNA delivery”, Bioactive Materials, 5, pp.358-363, DOI: 10.1016/j.bioactmat.2020.03.001.
[8] Linde Schoenmaker, Dominik Witzigmann, Jayesh A. Kulkarni, Rein Verbeke, Gideon Kersten, Wim Jiskoot, Daan J.A. Crommelin (2021), “mRNA-lipid nanoparticle COVID-19 vaccines: structure and stability”, International Journal of Pharmaceutics, 601(120586), pp.1-10, DOI: 10.1016/j.ijpharm.2021.120586.