“Con dao hai lưỡi”
Interleukin-2 (IL-2) là một thành viên của “đại gia đình cytokine”, được sản xuất bởi tế bào lympho T, có vai trò thiết yếu trong hệ thống miễn dịch, bao gồm: dung nạp miễn dịch (Tolerance) và sự miễn dịch (Immunity) thông qua tác động trực tiếp lên tế bào T. Đối với ung thư, IL-2 có thể giúp tiêu diệt các tế bào u ác tính ở bất cứ nơi nào chúng phát triển trong cơ thể thông qua 3 bước: 1) Ngăn chặn tế bào ung thư tăng sinh và lây lan; 2) Khiến tế bào ung thư tiết ra các chất hóa học để thu hút tế bào miễn dịch đến tiêu diệt; 3) Kích thích tế bào T phát triển để đến tấn công tế bào ung thư (hình 1) [1]. IL-2 đã được Cục Quản lý thực phẩm và dược phẩm Hoa Kỳ (FDA) chấp thuận trong điều trị ung thư tế bào thận di căn (1992) và ung thư hắc tố di căn (1998) sau khi các thử nghiệm lâm sàng chứng minh rằng, ở một số ít bệnh nhân có đáp ứng hoàn toàn với điều trị [2].
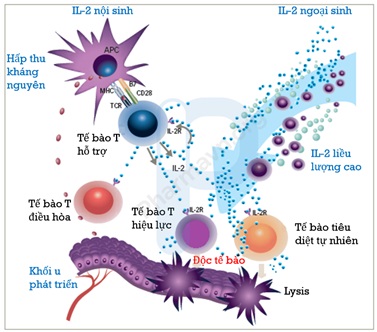
Hình 1. Cơ chế hoạt động của IL-2. Kích thích tế bào T tăng sinh và hoạt động; tăng cường tế bào tiêu diệt tự nhiên và hoạt động gây độc tế bào; kích hoạt sự giải phóng bởi các tế bào lympho đã hoạt hóa của cytokine, chẳng hạn như interferon gamma và yếu tố hoại tử khối u (Nguồn: Prometheus).
Các thử nghiệm lâm sàng tiếp theo cho thấy, IL-2 có hiệu quả vượt trội khi sử dụng ở liều lượng cao. Kể từ đó, IL-2 liều lượng cao đã trở thành một trong số ít liệu pháp điều trị ung thư tế bào thận và ung thư hắc tố di căn cho khả năng đáp ứng hoàn toàn bền vững mà không cần sử dụng thêm các liệu pháp điều trị khác. Bị thu hút bởi cơ chế ưu việt này, nhiều công ty dược đã chạy đua phát triển các thuốc điều trị ung thư dựa trên IL-2. Tuy nhiên, “cuộc vui sớm nở chóng tàn”, bởi vì mặc dù IL-2 cho đáp ứng điều trị ung thư mạnh mẽ, nhưng số người nhận được đáp ứng này lại rất ít. Các nhà khoa học cũng nhận ra rằng IL-2 là một con dao 2 lưỡi, IL-2 thúc đẩy sự tăng sinh của các tế bào T hiệu lực (effector T cells) giúp chống ung thư, nhưng đồng thời cũng thúc đẩy cả các tế bào T điều hòa (regulatory T cells) và các tế bào ức chế miễn dịch (immunosuppressive cells) giúp bảo vệ khối u…, dẫn đến hiệu quả điều trị bị hạn chế. Ngoài ra, nó chỉ hoạt động trong cơ thể trong một thời gian ngắn, nên phải được dùng 3 lần một ngày. Khi sử dụng ở liều lượng cao, IL-2 có thể gây ra hội chứng rò rỉ mao mạch làm ảnh hưởng đến nhiều hệ thống cơ quan, như hạ huyết áp, giảm tưới máu cơ quan (thậm chí dẫn đến tử vong), từ đó làm giảm liều lượng sử dụng [2, 3]. Vì các lý do nêu trên mà trong một khoảng thời gian dài IL-2 đã trở nên kém hấp dẫn đối với giới khoa học.
Sự trở lại của “nhà vua”
Để biến IL-2 thành một liệu pháp điều trị chống ung thư hiệu quả, bài toán lớn nhất cần giải quyết chính là làm sao để IL-2 ưu tiên kích hoạt tế bào T hiệu lực hơn là tế bào T điều hòa? Điều này đã dẫn đến sự quan tâm đối với cấu trúc của thụ thể IL-2 trên bề mặt tế bào T. Trải qua hơn một thập kỷ nghiên cứu, các nhà khoa học đã bất ngờ phát hiện ra rằng ở các tế bào T khác nhau có sự khác biệt về thụ thể IL-2. Đối với tế bào T điều hòa, thụ thể IL-2 của nó là loại tam trùng (trimeric) bao gồm chuỗi α-, β- và γ-. Trong khi đó, tế bào T non (Naive T cells) và tế bào tiêu diệt tự nhiên thì chứa thụ thể IL-2 nhị trùng (dimeric) bao gồm chuỗi β- và γ- (hình 2) [3].
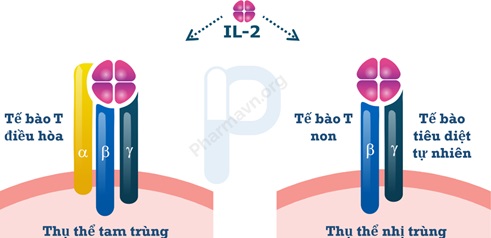
Hình 2. Thụ thể nhị trùng và thụ thể tam trùng (Nguồn: Anaveon).
Các thụ thể tam trùng có ái lực với IL-2 cao hơn khoảng 100 lần so với các thụ thể nhị trùng, đó là lý do tại sao IL-2 phải được sử dụng ở liều lượng cao để có thể kích hoạt hệ thống miễn dịch nhằm tiêu diệt ung thư. Thách thức kế tiếp chính là liệu có cách nào khiến IL-2 không thể liên kết với chuỗi α- để từ đó ưu tiên liên kết với thụ thể IL-2 nhị trùng nhằm tăng khả năng chống ung thư?
Chris Garcia - nhà nghiên cứu sinh học phân tử tại Đại học Stanford đã chỉ ra cách tiếp cận như vậy là hoàn toàn có thể. Để chứng minh, ông đã công bố nghiên cứu trên Tạp chí Nature về một biến thể “superkine” IL-2 có ái lực cao với thụ thể IL-2 chuỗi β-, có thể trở thành một công tắc mạnh mẽ giúp kích hoạt và tăng sinh các tế bào miễn dịch cần thiết để chống lại ung thư. Sau đó, ông đã đăng ký bản quyền và cấp phép sử dụng biến thể này lại cho Công ty Medicenna hiện đang chuẩn bị đưa ứng cử viên thuốc MDNA11 vào thử nghiệm lâm sàng.
Cùng lúc đó, 2 công ty dược phẩm Mỹ là Bristol Myers Squibb và Nektar Therapeutics đã bắt đầu tạo dữ liệu lâm sàng về loại IL-2 có ái lực cao với chuỗi β- và γ-, với ứng cử viên là Bempegaldesleukin. Bempegaldesleukin là một dạng tái tổ hợp giữa IL-2 với 6 nhóm PEG có thể phân tách được, giúp tăng thời gian bán hủy của cytokine. Bằng cách liên kết nhóm PEG với lysine gần nơi IL-2 liên kết với chuỗi α- của thụ thể IL-2, có thể giúp ngăn chặn IL-2 tương tác với thụ thể IL-2 tam trùng. Khi Bempegaldesleukin được thủy phân đến trạng thái hoạt động mạnh nhất (chỉ có một nhóm PEG duy nhất được gắn vào), nó sẽ ưu tiên thúc đẩy sự tăng sinh của các tế bào T hiệu lực hơn là các tế bào T điều hòa. Nektar đã đưa loại thuốc này vào thử nghiệm lâm sàng vào năm 2015. Năm 2017, dữ liệu sơ bộ đã cho các kết quả đầy hứa hẹn đối với ung thư tế bào hắc tố dòng một, dòng hai và ung thư phổi không tế bào nhỏ âm tính với PDL1. Thử nghiệm giai đoạn III sẽ được tiến hành vào giữa năm 2022. Các dữ liệu an toàn của Bempegaldesleukin đã khiến nhiều công ty dược quay trở lại cuộc đua nghiên cứu và phát triển các loại thuốc điều trị (bảng 1) [3].
Bảng 1. Danh sách ứng viên IL-2.
|
Tên thuốc
|
Công ty (Quốc gia)
|
Đặc tính
|
Đối tượng
|
Giai đoạn
|
|
Bempegaldesleukin
(NKTR-214)
|
Nektar Therapeutics, Bristol Myers Squibb (Mỹ)
|
IL-2, với sáu nhóm PEG có thể phân tách
|
Ung thư hắc tố
Ung thư tế bào thận
Ung thư bàng quang
|
III
|
|
Nemvaleukin alfa
|
Alkermes (Ireland)
|
Protein dung hợp biến thể IL-2 và thụ thể IL-2 chuỗi α- hoán vị mạch vòng
|
Ung thư đầu và cổ
|
II
|
|
SAR444245
|
Sanofi (Pháp) /Synthorx (Mỹ)
|
IL-2, với một nhóm PEG không thể phân cắt
|
Bướu đặc
|
I/II
|
|
RG6279
|
Roche (Thụy Sỹ)
|
Protein dung hợp biến thể IL-2 và kháng thể đơn dòng ức chế PD1
|
Bướu đặc
|
I
|
|
CUE-101
|
Cue Biopharma (Mỹ)
|
Protein dung hợp phức hợp IL-2 - HLA và peptit HPV16 E7
|
Ung thư đầu và cổ
|
I
|
|
NL-201
|
Neoleukin Therapeutics (Mỹ)
|
Protein bắt chước IL-2, được thiết kế từ máy tính
|
-
|
Thuốc mới sắp được thử nghiệm lâm sàng
|
|
AU-007
|
Aulos Bioscience (Mỹ)
|
Kháng thể đơn dòng ức chế IL-2, được thiết kế từ máy tính
|
-
|
IND
|
|
STK-012
|
Synthekine (Mỹ)
|
Chất chủ vận một phần IL-2, nhắm mục tiêu các tế bào T đã kích hoạt
|
-
|
IND vào năm 2021
|
|
KY1043
|
Kymab (Anh)
|
Protein dung hợp biến thể IL-2 và kháng thể đơn dòng ức chế PD1
|
-
|
IND vào năm 2021
|
|
BNT151
|
BioNTech (Đức)
|
Biến thể IL-2, mã hóa mRNA
|
-
|
IND vào năm 2021
|
|
MDNA11
|
Medicenna Therapeutics (Canada)
|
IL-2 ‘superkine’
|
-
|
IND vào năm 2021
|
|
WTX-124
|
Werewolf Therapeutics (Mỹ)
|
IL-2 được kích hoạt có điều kiện
|
-
|
Tiền lâm sàng
|
Đặc biệt, Công ty Synthorx (Mỹ) đã thực hiện một cách tiếp cận khác hoàn toàn mới mẻ. Họ đã gắn một nhóm PEG không thể phân tách vào axit amin không tự nhiên để tạo ra một ứng viên IL-2 đồng nhất “không phải chuỗi α-”. Năm 2020, Công ty đã báo cáo sơ bộ việc thử nghiệm giai đoạn I và cho thấy thuốc SAR444245 của họ kích thích tăng sinh các tế bào T non và tế bào tiêu diệt tự nhiên ngoại vi mà không thúc đẩy các tế bào T điều hòa. Thử nghiệm tương tự cũng cho thấy, SAR444245 an toàn với liều lượng lên đến 24 µg/kg (gấp đôi so với những gì Nektar Therapeutics đạt được) trước khi nó đạt được độc tính giới hạn liều lượng. Kết quả này là cơ sở quan trọng để Công ty Sanofi (Pháp) quyết định mua lại Synthorx với giá 2,5 tỷ USD vào năm 2019. Hiện tại, Sanofi đang tiến hành thử nghiệm lâm sàng giai đoạn I/II trên 300 bệnh nhân đối với SAR444245 dưới dạng đơn trị liệu, SAR444245 kết hợp với thuốc khóa PD1 và SAR444245 kết hợp với kháng thể ức chế EGFR. Bên cạnh đó, Synthorx với vị trí là công ty con của Sanofi cũng hợp tác với công ty dược phẩm Merck&Co. (Mỹ) để thử nghiệm giai đoạn II của SAR444245 khi kết hợp với Pembrolizumab.
Các công ty khác cũng đã áp dụng các chiến lược khác nhau để hướng IL-2 đến tế bào T hiệu lực, như Công ty Alkermes (Ireland) thử nghiệm lâm sàng giai đoạn II cho thuốc Nemvaleukin alfa - một biến thể IL-2 được hợp nhất với chuỗi α, giúp ngăn chặn khả năng tương tác của IL-2 với chuỗi α của thụ thể IL-2 trên bề mặt tế bào T điều hòa [3].
Như vậy, với sự tham gia của các công ty dược lớn, cuộc chạy đua tìm ra liệu pháp miễn dịch điều trị ung thư đã trở nên thú vị hơn bao giờ hết. Hy vọng một loại thuốc miễn dịch giúp điều trị ung thư sẽ sớm trở thành hiện thực, giúp tiêu diệt có chọn lọc các tế bào ung thư.
TÀI LIỆU THAM KHẢO
[1] https://www.curemelanoma.org/patient-eng/melanoma-treatment/immunotherapy/interleukin-2-il-2-proleukin [cited 2nd Mar 2021].
[2] G. Shilpa, A. Neeraj (2016), “Cancer immunotherapy with Interleukin-2- current status and future developments”, Oncology & Hematology Review, https://touchoncology.com/genitourinary-cancers/journal-articles/cancer-immunotherapy-with-interleukin-2-current-status-and-future-developments/.
[3] M. Asher (2021), “Restoring IL-2 to its cancer immunotherapy glory”, Nature Reviews Drug Discovery, https://www.nature.com/nrd/.