Mở đầu
Nhu cầu lương thực ngày càng tăng do áp lực dân số là một trong những thách thức lớn nhất đối với sản xuất nông nghiệp trên thế giới. Mức tiêu thụ này không chỉ tăng lên do tăng trưởng dân số toàn cầu (dự tính vượt 9 tỷ người vào năm 2050), mà còn do mức tiêu thụ protein động vật bình quân đầu người tăng [1]. Các sản phẩm từ động vật, như sữa, thịt và trứng cung cấp khoảng 13% năng lượng và 28% lượng protein được tiêu thụ trên toàn cầu. Trong đó, sữa và thịt từ trâu, bò đóng góp 45% nguồn cung cấp protein động vật toàn cầu, tiếp theo là gà (31%) và lợn (20%) [2]. Nhu cầu về tiêu thụ thịt lợn và thịt bò trên toàn thế giới được dự đoán có thể tăng tới 43 và 66% vào năm 2050, tạo sức ép lớn cho ngành chăn nuôi (hình 1). Các phương pháp lai tạo truyền thống để cải thiện sức khỏe, dinh dưỡng, sinh sản và quản lý vật nuôi đã đạt được những đột phá nhất định. Tuy nhiên, quá trình lai tạo này thường đòi hỏi nhiều vòng đời để có thể tích hợp gen mục tiêu vào dòng mẹ.
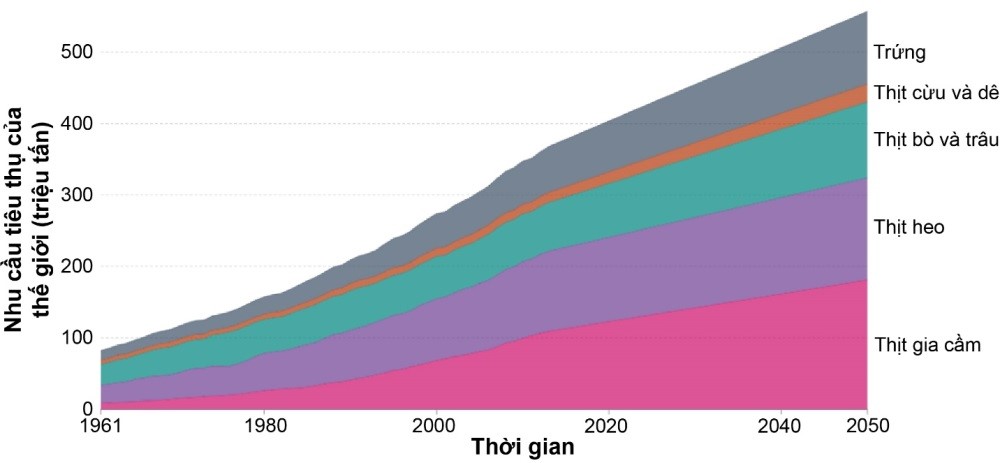
Hình 1. Nhu cầu tiêu thụ thịt của thế giới. Nguồn: FAO (2021).
Chỉnh sửa gen là một trong những công cụ can thiệp vào vật chất di truyền, đã mở ra “cánh cửa” mới trong lĩnh vực chăn nuôi và bảo tồn động vật. Thông qua khả năng cắt gen chính xác, các hệ thống chỉnh sửa sử dụng enzyme cắt DNA ngón tay kẽm (Zinc finger nuclease, ZFN), enzyme cắt DNA giống yếu tố hoạt hóa phiên mã (Transcription activator - like effector nucleases, TALEN) và enzyme cắt DNA gắn vào nhóm các trình tự lặp lại (CRISPR/Cas) [3] hứa hẹn tạo ra các dòng đột biến có khả năng thích nghi với điều kiện môi trường khắc nghiệt, cải thiện chất lượng sản phẩm thịt, sữa, kiểm soát dịch hại cũng như tạo ra các mô hình chỉnh sửa gen động vật cỡ nhỏ cho những nghiên cứu cơ bản [2, 4, 5].
Hệ thống chỉnh sửa gen dựa trên CRISPR/Cas và những thành tựu đạt được
CRISPR/Cas là công cụ chỉnh sửa gen thế hệ mới, giúp tạo ra một cuộc cách mạng trong nghiên cứu chức năng gen ở cấp độ in vivo và in vitro. Hệ thống này cho phép thay đổi chức năng của gen bằng cách xóa/chèn nucleotide tại vị trí xác định. So với phương pháp chỉnh sửa gen sử dụng hệ thống ZFN và TALEN, việc thiết kế một đoạn RNA ngắn dẫn hướng (single guide RNA, sgRNA) đơn giản và nhanh chóng thông qua nhiều phần mềm tin sinh học, tỷ lệ chỉnh sửa gen cao, có thể chỉnh sửa đồng thời nhiều gen - được gọi là chỉnh sửa đa gen [6]. Đến nay, các hệ thống CRISPR/Cas đã được sử dụng phổ biến để chỉnh sửa (các) gen của vi khuẩn, thực vật cũng như động vật [3, 7].
Khi sử dụng hệ thống CRISPR/Cas, việc lựa chọn và thiết kế enzyme nuclease Cas đóng vai trò quan trọng nhằm đảm bảo tính hiệu quả và độ chính xác của quá trình chỉnh sửa gen. Yếu tố thứ hai cần quan tâm trong hệ thống CRISPR/Cas là việc thiết kế sgRNA dẫn hướng. Đó là các locus gen chứa đoạn trình tự 5′-NGG-3’, gọi là mô típ liền kề protospacer (PAM). Trình tự PAM xuất hiện ngay sau vị trí cần chỉnh sửa để enzyme nuclease Cas nhận biết thông qua sự dẫn hướng của sgRNA. Chỉnh sửa gen trên các mô hình động vật khác nhau thường ảnh hưởng bởi các cấu trúc sgRNA khác nhau [8]. Về mặt lý thuyết, việc thiết kế sgRNA dựa trên nguyên lý đầu tận cùng 5’ của sgRNA có trình tự 20 nucleotide bổ sung cho trình tự gen mục tiêu, khi đó phức hợp sgRNA-Cas9 sẽ liên kết đặc hiệu với vị trí cắt và tạo ra phản ứng phân cắt. Các mô hình thiết kế cần phải đảm bảo được tính đặc hiệu của sgRNA để giảm thiểu hiệu ứng đột biến ngoài mục tiêu (bảng 1). Việc gây ra các đột biến không mong muốn khi chỉnh sửa gen ở phôi thai động vật cần phải được xem xét cẩn trọng do thời gian mang thai thường kéo dài và đòi hỏi hệ thống chăm sóc tốn kém, do vậy cần tiến hành các phân tích trên hệ tự do ngoài tế bào (cell-free system), nuôi cấy tế bào in vitro hoặc kiểm tra trực tiếp trên phôi đột biến. Giải trình tự gen của phôi đột biến để kiểm tra hiệu quả chỉnh sửa cần được tiến hành trước khi tiến hành chuyển phôi [2].
Bảng 1. Một số công cụ thiết kế sgRNA dẫn hướng.
|
STT
|
Công cụ
|
Dữ liệu truy vấn
|
Tên miền
|
|
1
|
CROP-IT
|
Vùng genomic
|
http://cheetah.bioch.virginia.edu/AdliLab/CROP-IT/homepage.html
|
|
2
|
CRISPR Multi Targeter
|
Trình tự gen
Mã định danh gen
Ký hiệu gen
Mã định danh RNA
Trình tự RefSeq
|
http://www.multicrispr.net/
|
|
3
|
CLD
|
Vùng genomic
Mã định danh gen
|
https://github.com/boutroslab/cld
|
|
4
|
CRISPOR
|
Trình tự gen
Vùng genomic
|
http://crispor.tefor.net/
|
|
5
|
sgRNA Scorer 2.0
|
Trình tự gen
|
https://crispr.med.harvard.edu/sgRNAScorerV2/
|
|
6
|
GuideScan
|
Ký hiệu gen
Vùng genomic
|
http://www.guidescan.com/
|
|
7
|
CASPER
|
Trình tự gen
|
https://github.com/TrinhLab/CASPER
|
Hiện nay, công nghệ CRISPR/Cas đã được ứng dụng để cải thiện năng suất, chất lượng vật nuôi trên nhiều loài động vật (hình 2) với nhiều thành tựu nổi bật.
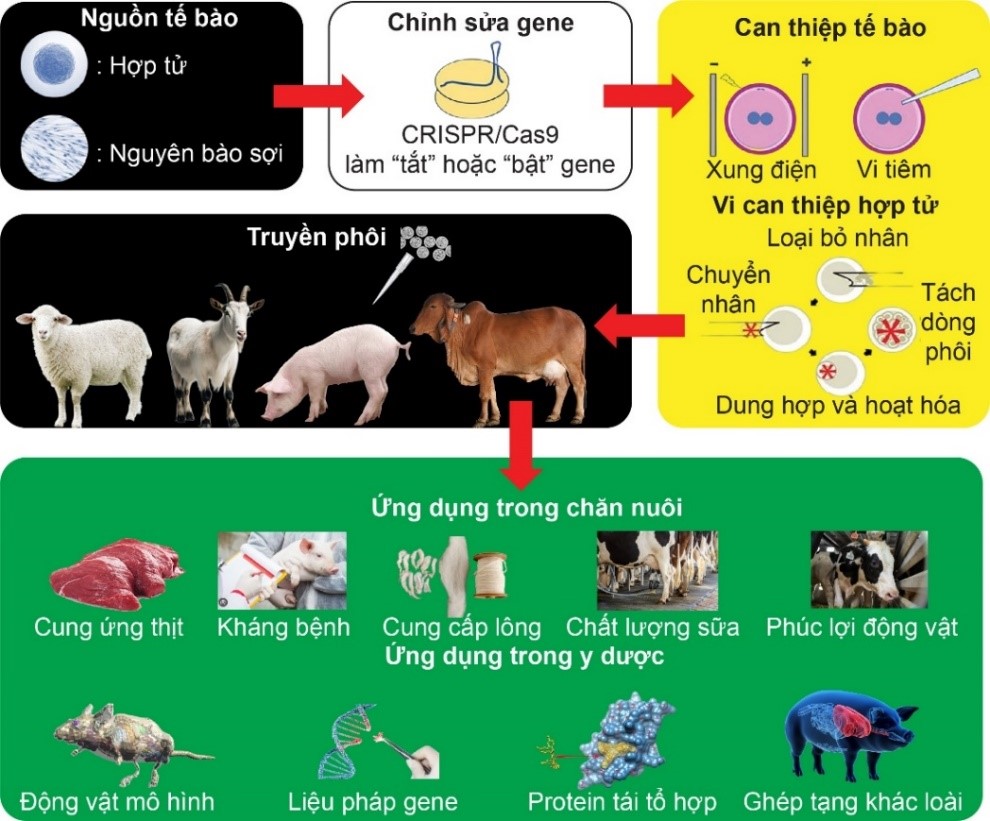
Hình 2. Ứng dụng công nghệ CRISPR/Cas vào chỉnh sửa gen trên động vật [2].
Đến nay, nhiều dòng gia súc đột biến đã được tạo ra bằng hệ thống CRISPR/Cas như: dòng lợn đột biến có khả năng chống lại hội chứng rối loạn sinh sản và hô hấp thông qua việc chỉnh sửa làm mất chức năng của gen CD163 (mã hóa cho thụ thể được tìm thấy trên đại thực bào phế nang ở lợn liên quan đến sự xâm nhập của virus). Các cá thể lợn được chỉnh sửa gen CD163 cho thấy khả năng kháng lại virus, và không có dấu hiệu lâm sàng như sốt hoặc hô hấp. Dịch tả lợn châu Phi là bệnh truyền nhiễm do virus gây bệnh sốt xuất huyết là một trong những thách thức trong chăn nuôi lợn tại các quốc gia ở châu Á hiện nay. Một đột biến cấu trúc xảy ra ở gen RELA mã hóa tiểu phần của nhân tố phiên mã NF-κB đã giúp cho loài lợn rừng châu Phi có khả năng kháng lại virus này. Do đó, chỉnh sửa gen RELA có thể là giải pháp tiềm năng cho việc tạo ra các thế hệ lợn nhà đột biến có khả năng kháng lại dịch tả lợn châu Phi. Trong một nghiên cứu khác, công cụ CRISPR/Cas cũng đã được sử dụng để tạo ra thế hệ lợn kháng virus Corona thông qua việc chỉnh sửa gen mã hóa amino peptidase N (một thụ thể cho virus gây bệnh viêm dạ dày ruột truyền nhiễm và virus gây tiêu chảy cấp ở lợn). Ở Trung Quốc, bò chỉnh sửa gen NRAMP1 mã hóa protein vận chuyển Mn2+ có khả năng kháng bệnh lao... Những thành tựu này cho thấy tiềm năng của CRISPR/Cas như một công cụ hữu hiệu giúp tạo ra các dòng vật nuôi đột biến có khả năng kiểm soát bệnh truyền nhiễm
Cố gắng loại bỏ sừng của các cá thể bò sữa là một trong những nỗ lực của ngành chăn nuôi nhằm hạn chế tổn thương trong quá trình chăm sóc. Các nhà khoa học đã xác định được locus POLLED kiểm soát tính trạng không sừng, xuất hiện ở các loài bò thông thường (như Angus) nhưng không được báo cáo trên các giống bò sữa (như Holstein Friesian). Trong đó, ít nhất 2 allen đột biến được dự đoán xảy ra ở locus POLLED trên nhiễm sắc thể số 1 ở bò cách đây 500-1000 năm trước, bao gồm một allen chứa đoạn lặp có kích thước 80.128 bp trên giống bò sữa Holstein Friesian (Hà Lan) và một allen PC có đoạn chứa đoạn lặp có kích thước 212 bp trên giống bò Celtic. Theo đó, allen PC POLLED được tích hợp vào genome trong tế bào nguyên bào sợi từ phôi bò bằng hệ thống TALEN, từ đó 4 dòng tế bào mang allen POLLED ở trạng thái đồng hợp tử (HP14-B6, HP14-B4 và HP7-P4-A1) và dị hợp tử (HP-24.8) đã tạo ra 5 con bê mang hai nền di truyền khác nhau [9]. Bên cạnh đó, điều khiển giới tính ở phôi động vật bằng hệ thống CRISPR/Cas cũng đang được xem là một lợi thế trong tăng cường sản xuất sinh khối, ví dụ cá thể đực có thể cung cấp thịt và cá thể cái có thể cung cấp sữa nhiều hơn.
Giống cừu Texel của Hà Lan phổ biến trên thế giới do có khả năng tăng trưởng tốt và năng suất thịt cao, nhưng chất lượng len kém, tính trạng này được giải thích do có một đột biến ở gen MSTN làm thay đổi quá trình phát triển và biệt hóa của tế bào cơ. Để chứng tỏ việc ức chế chức năng gen MSTN giúp cải thiện khối lượng cơ, phôi cừu Merino Superfine (cho chất lượng len tốt nhất nhưng kích thước và tốc độ tăng trưởng kém) được lựa chọn để gây đột biến mất chức năng gen MSTN giúp cải thiện chất lượng thịt, các cá thể cừu chỉnh sửa gen có trọng lượng cơ thể và tốc độ tăng trưởng nhanh nhưng vẫn giữ được chất lượng len. Bên cạnh đó, để cải thiện chất lượng thịt, các nhà khoa học Trung Quốc đã chỉnh sửa gen MSTN và FGF5 (mã hóa yếu tố tăng trưởng nguyên bào sợi, fibroblast growth factor 5) trên phôi của giống dê Cashmere (có lông chất lượng cao). Kết quả tương tự cũng được ghi nhận khi gây đột biến gen MSTN bằng hệ thống CRISPR/Cas9 làm tăng chất lượng thịt trên lợn.
Hiệu quả tạo ra động vật có vú chỉnh sửa gen có thể được cải thiện bằng cách kết hợp các kỹ thuật di truyền và kỹ thuật tế bào như tiêm trực tiếp vào phôi sau khi thụ tinh nhân tạo, tuy nhiên điều này vẫn bị hạn chế bởi khó khăn của việc tiếp cận nhân tế bào trong trứng được thụ tinh [4]. Do vậy, một số loài chim, điển hình như gà, từ lâu đã được sử dụng làm đối tượng trong thử nghiệm hệ thống CRISPR/Cas. Ví dụ, gây mất chức năng gen G0S2 bằng CRISPR/Cas9 được chứng minh làm giảm khả năng tích lũy lipid ở gà nhưng ảnh hưởng không đáng kể đến các tính trạng khác. Tương tự, cá thể gà đột biến mất chức năng gen MSTN (mã hóa myostatin liên quan kiểm soát và phát triển cơ) được tạo ra bằng công nghệ CRISPR/Cas9 thể hiện kiểu hình tăng cơ giảm mỡ [10]. Gần đây, nỗ lực của các nhà khoa học cũng đã được ghi nhận trong việc tạo ra dòng gà đột biến có khả năng kháng lại virus gây bệnh bạch cầu ở gia cầm. Dị ứng với ovomucoid trong lòng đỏ trứng gà cũng là một trong những trường hợp đang được quan tâm hiện nay [11]. Ovomucoid đóng vai trò như một chất ức chế trypsin, ngăn chặn hoạt động của enzyme tiêu hóa trypsin trong hệ tiêu hóa, do đó gây ra các triệu chứng dị ứng (đau bụng, nổi mẩn, sốc phản vệ) [11]. Sử dụng CRISPR/Cas9 đã tạo ra những cá thể gà đột biến mất chức năng gen OVM, trứng từ các cá thể gà đột biến được ghi nhận đã loại bỏ gần như hoàn toàn ovomucoid, từ đó mở ra tiềm năng trở thành nguồn thực phẩm không gây dị ứng cho hầu hết bệnh nhân bị dị ứng với trứng [11]. Một số thành tựu trong việc tạo ra các dòng gà đột biến bằng công nghệ chỉnh sửa gen từ CRISPR/Cas9 cũng đã được ghi nhận nhằm xác định giới tính ở giai đoạn sớm [12], sản xuất thương mại protein tái tổ hợp như hIFN-β (cytokine thuộc nhóm interferon ở người) từ lòng trắng trứng gà. Có thể thấy rằng, động vật chỉnh sửa gen có thể mang lại lợi ích cho ngành chăn nuôi trong tương lai gần. Phát triển các dòng gà đột biến không chỉ giúp can thiệp vào những tính trạng mong muốn để giải quyết nhu cầu trong cung ứng thực phẩm, mà còn đưa ra mô hình cho phép mở rộng đối tượng thử nghiệm chỉnh sửa gen [2, 4].
Cải thiện khả năng kháng bệnh ở các loài động vật cũng là một trong những tiêu chí của công tác lai tạo giống. Ví dụ, hội chứng rối loạn sinh sản và hô hấp do virus gây ra triệu chứng chán ăn, bỏ ăn, sốt, khó thở, sảy thai, khô thai ở lợn làm thiệt hại khoảng 2,5 tỷ USD mỗi năm ở Mỹ và các nước châu Âu. Trong bối cảnh vắc-xin chưa có khả năng kiểm soát được virus, cá thể lợn đột biến làm mất chức năng của gen CD163 bằng hệ thống CRISPR/Cas9 đã đạt được bước đột phá lớn, thể hiện khả năng kháng lại virus và không có dấu hiệu lâm sàng như sốt hoặc hô hấp. Đến nay, các thế hệ lợn đột biến được lai tạo tại Mỹ và Scotland đã thể hiện khả năng kháng các chủng virus gây bệnh ở khu vực Bắc Mỹ và châu Âu.
Định hướng nghiên cứu chỉnh sửa gen trên các đối tượng động vật
Chỉnh sửa gen với hệ thống CRISPR/Cas đang mở ra những khám phá mới, mang lại ưu điểm vượt xa so với những kỹ thuật chuyển gen truyền thống trong phòng thí nghiệm. Sự phát triển của công cụ này cho phép tạo ra cá thể đột biến mang (các) gen được chỉnh sửa có định hướng, từ đó tạo ra học thuyết về truyền động gen (gene drive). Nhờ tính ưu việt của công nghệ chỉnh sửa gen, thời gian và nỗ lực cần thiết để phát triển và đánh giá an toàn của sản phẩm được phát triển bởi công nghệ này sẽ ngắn hơn và ít hơn tương ứng.
Hiện nay, bên cạnh việc lai tạo ra các dòng cá thể đột biến, hệ thống Bioreactor được thiết kế để nuôi cấy sinh khối dòng tế bào động vật chỉnh sửa gen, giúp tổng hợp protein tái tổ hợp hoặc các sản phẩm trao đổi thứ cấp. Các phương pháp sản xuất protein tái tổ hợp truyền thống thường sử dụng vi khuẩn, nấm men và hệ thống nuôi cấy tế bào động vật có vú thường tốn kém, phức tạp và gặp một số vấn đề trong quá trình sửa đổi sau dịch mã, sinh khối tạo ra có thể gây ra phản ứng miễn dịch trên người [13]. Một số protein tái tổ hợp, như cytokine và kháng thể có thể được sản xuất dựa trên nuôi cấy dòng tế bào thận phôi người (HEK293) và buồng trứng chuột hamster (CHO). Ví dụ, dòng tế bào CHO mang đột biến mất chức năng gen mã hóa glutamine synthetase, và HEK293 mang đột biến mất chức năng gen mã hóa dihydrofolate reductase tạo ra bằng hệ thống CRISPR/Cas9 có thể sử dụng trong nuôi cấy Bioreactor để sản xuất methotrexate (điều trị kháng dị ứng), và methionine sulfoximine (chống viêm) [4, 5, 14].
Khả năng loại bỏ hoặc thay đổi cấu trúc gen một cách chính xác là nền tảng để xác định chức năng gen nhằm cải biến di truyền. Đối với vật nuôi, chiến lược gây mất chức năng gen đã tạo ra nhiều thành tựu lớn trong việc cải thiện khả năng kháng bệnh, giảm nguy cơ lây truyền bệnh từ động vật, thay đổi đặc điểm sản xuất và nâng cao phúc lợi động vật [3, 4, 13]. Tuy nhiên, hiện tượng đột biến ngoài mục tiêu cũng là một hạn chế và thách thức khi sử dụng hệ thống CRISPR/Cas9 trong chỉnh sửa gen mục tiêu trên động vật. Do đó, vấn đề về an toàn và đạo đức khi sử dụng trong liệu pháp gen cho động vật cần phải được xem xét.
Mặc dù công cụ chỉnh sửa gen sử dụng hệ thống CRISPR/Cas đã đạt được nhiều thành tựu, tuy nhiên việc quản lý các sự kiện chỉnh sửa gen trên đối tượng động vật vẫn cần được kiểm soát một cách chặt chẽ. Năm 2017, Cục Quản lý Thực phẩm và Dược phẩm Mỹ đã ra mắt dự thảo hướng dẫn về “Quy định về việc thay đổi có chủ đích genome của động vật” [15]. Argentina cũng đưa ra quy định quản lý công nghệ lai tạo mới (New breeding technique, NBT) trên đối tượng động vật và vi sinh vật năm 2019 [15]. Đến năm 2020, các quy định về NBT đã được cập nhật và đơn giản hóa, nhằm quản lý các sự kiện chỉnh sửa gen có thuộc sinh vật biến đổi gen hay không, dựa theo các đánh giá phiên bản tham vấn trước. Đối với Việt Nam, chúng ta phải trả lời được câu hỏi về việc có nhất thiết phải sử dụng công cụ chỉnh sửa gen để giải quyết các bài toán trong chăn nuôi (cải thiện năng suất/sản lượng/chất lượng protein, tính kháng bệnh, tăng cường khả năng thích ứng với biến đổi khí hậu và giảm thiểu tác động đến môi trường). Theo đó, chỉnh sửa gen có phải là công cụ duy nhất để giải quyết các bài toán này hay không và các tác động môi trường của các dòng đột biến ra sao? Trong tương lai, chúng ta cần chuẩn bị một nền tảng về đội ngũ nhân lực được trang bị đầy đủ các kiến thức, kinh nghiệm về chỉnh sửa gen và các kỹ thuật phụ trợ (thụ tinh trong ống nghiệm, biến nạp gen, giải trình tự gen thế hệ mới, đánh giá kiểu hình thông lượng cao).
TÀI LIỆU THAM KHẢO
[1] E. Perraud, J. Wang, M. Salomé, et al. (2022), "Plant and animal protein intakes largely explain the nutritional quality and health value of diets higher in plants: A path analysis in French adults", Front. Nutr., 9, DOI: 10.3389/fnut.2022.924526.
[2] I.V. Perisse, Z. Fan, G.N. Singina, et al. (2021), "Improvements in gene editing technology boost its applications in livestock", Front. Genet., 11, DOI: 10.3389/fgene.2020.614688.
[3] A. Menchaca, P.C.D. Santos-Neto, A.P. Mulet, et al. (2020), "CRISPR in livestock: From editing to printing", Theriogenology, 150, DOI: 10.1016/j.theriogenology.2020.01.063.
[4] T.S. Park (2023), "Gene-editing techniques and their applications in livestock and beyond", Anim. Biosci., 36(2), pp.333-338, DOI: 10.5713/ab.22.0383.
[5] C.N. Khwatenge, S.N. Nahashon (2021), "Recent advances in the application of CRISPR/Cas9 gene editing system in poultry species", Front. Genet., 12, DOI: 10.3389/fgene.2021.627714.
[6] A.M. Khalil (2020), "The genome editing revolution: Review", J. Genet. Eng. Biotechnol., 18(1), DOI: 10.1186/s43141-020-00078-y.
[7] A.K. Wani, N. Akhtar, R. Singh, et al. (2023), "Genome centric engineering using ZFNs, TALENs and CRISPR-Cas9 systems for trait improvement and disease control in animals", Vet. Res. Commun., 47(1), pp.1-16, DOI: 10.1007/s11259-022-09967-8.
[8] J.Q. Zhang, J.X. Guo, X.J. Wu, et al. (2022), "Optimization of sgRNA expression strategy to generate multiplex gene-edited pigs", Zool. Res., 43(6), pp.1005-1008, DOI: 10.24272/j.issn.2095-8137.2022.244.
[9] J.H. Sollner, T.C. Mettenleiter, B. Petersen (2021), "Genome editing strategies to protect livestock from viral infections", Viruses, 13(10), DOI: 10.3390/v13101996.
[10] G.D. Kim, J.H. Lee, S. Song, et al. (2020), "Generation of myostatin-knockout chickens mediated by D10A-Cas9 nickase", FASEB J., 34(4), pp.5688-5696, DOI: 10.1096/fj.201903035R.
[11] T. Mukae, K. Yoshii, T. Watanobe, et al. (2021), "Production and characterization of eggs from hens with ovomucoid gene mutation", Poult. Sci., 100(2), pp.452-460, DOI: 10.1016/j.psj.2020.10.026.
[12] J. Ioannidis, G. Taylor, D. Zhao, et al. (2021), "Primary sex determination in birds depends on DMRT1 dosage, but gonadal sex does not determine adult secondary sex characteristics", Proc. Natl. Acad. Sci. USA, 118(10), DOI: 10.1073/pnas.2020909118.
[13] A.N. Hay, K. Farrell, C.M. Leeth, et al. (2022), "Use of genome editing techniques to produce transgenic farm animals", Adv. Exp. Med. Biol., 1354, pp.279-297, DOI: 10.1007/978-3-030-85686-1_14.
[14] L.S.A. Camargo, N.Z. Saraiva, C.S. Oliveira , et al. (2022), "Perspectives of gene editing for cattle farming in tropical and subtropical regions", Anim. Reprod., 19(4), DOI: 10.1590/1984-3143-AR2022-0108.
[15] M.F. Goberna, A.I. Whelan, P. Godoy, et al. (2022), "Genomic editing: The evolution in regulatory management accompanying scientific progress", Front. Bioeng. Biotechnol., 10, DOI: 10.3389/fbioe.2022.835378.