Những cột mốc quan trọng đầu tiên trong nghiên cứu về lão hóa
Thí nghiệm của nhóm nghiên cứu do GS Sinclair dẫn đầu (gọi tắt là nhóm Sinclair) là sự tiếp nối thành công nghiên cứu trước đây của GS Shinya Yamanaka trong việc tái lập lại tế bào gốc vạn năng từ tế bào da ở người. Từ đó, tế bào gốc vạn năng có thể biệt hóa thành bất kỳ loại tế bào nào khác trong cơ thể, đồng thời bốn nhân tố chính trong chu trình tái lập tế bào gốc là Oct4, Sox2, Klf4 và c-Myc (OSKM). Nghiên cứu của GS Shinya Yamanaka đã được trao Giải Nobel 2012 (cùng với GS John B. Gurdon). Sau đó tên GS Shinya Yamanaka đã được đặt cho chính những phát kiến của ông: “Yamanaka factors - Các yếu tố Yamanaka”. Tuy nhiên, tế bào người sau khi chuyển ngược lại thành tế bào gốc thông qua các yếu tố Yamanaka đã bị mất khả năng “nhận diện” chính mình. Nói các khác, các tế bào “quên” mất mình là tế bào từ máu, tế bào tim hoặc tế bào da, giống như việc các tế bào đó đã được tái sinh, đồng thời quên mất “tiền kiếp” của mình.
Sau nghiên cứu Yamanaka, một nghiên cứu khác được xuất bản trên tạp chí Cell vào năm 2016 chỉ ra rằng, ở mô hình chuột đã được biến đổi di truyền để thúc đẩy lão hóa, khi đưa các yếu tố Yamanaka vào cơ thể chuột trong một thời gian ngắn có thể xóa các dấu hiệu lão hóa, thậm chí là kéo dài tuổi thọ mà không làm mất đi khả năng nhận diện của tế bào. Tuy nhiên trong một số trường hợp, chuột được “trẻ hóa” có nguy cơ phát triển ung thư.
Với phương pháp thay thế an toàn hơn, nhóm Sinclair đã chọn ra 3 trong số 4 yếu tố Yamanaka bao gồm Oct4, Sox2, và Klf4 (OSK) đưa vào virus vô hại (dual adeno-associated virus system - tạm dịch: hệ vectơ virut Adeno kép), sau đó tiêm vào trong thể thủy tinh, ngay phía sau viền giác mạc bị tổn thương của mắt chuột già. Sau khi tiêm virus vào, các gen sẽ được kích hoạt bằng kháng sinh Doxycycline qua đường uống. Kết quả thật đáng kinh ngạc, các tế bào thần kinh bị thương tổn tại mắt chuột đã “trẻ hóa”, thậm chí còn phát triển các sợi trục mới nối từ mắt tới não. Nhóm Sinclair cho rằng, 3 yếu tố OSK có thể khôi phục lại kiểu methyl hóa DNA và hệ phiên mã như khi còn trẻ, thúc đẩy tái tạo sợi trục sau chấn thương và đảo ngược tình trạng mất thị lực ở mô hình chuột mắc glaucoma và chuột già.
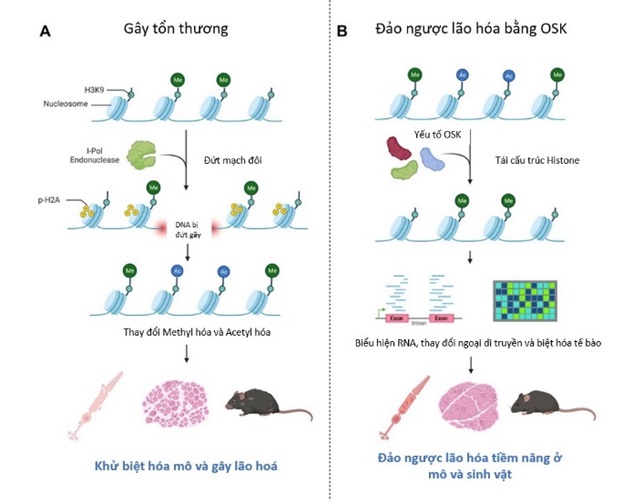
Hình 1. Sơ đồ nghiên cứu của nhóm Sinclair.
Ngoại di truyền và đứt gãy mạch đôi DNA có liên quan tới quá trình lão hóa
Đầu năm 2023, nhóm Sinclair đã công bố thêm một phát hiện mới với giả thiết rằng, đứt gãy mạch đôi DNA (double-strand break - DSB) có liên quan tới điều chỉnh ngoại di truyền và lão hóa ở chuột.
Để tạo DSB tại vị trí đặc hiệu ở tế bào, nhóm Sinclair đã sử dụng enzym endonuclease I-Pol (một loại enzym có khả năng nhận diện 19 vùng không mã hóa và 1 vùng ribosome của DNA mạch đôi), nhằm tạo ra các đoạn cắt mục tiêu mà không làm mất hoặc tăng thêm đoạn DNA. Các DSB kích hoạt các sửa đổi chromatin qua γ-H2AX (phospho hóa của histone 2A isoform H2AX), đẩy mạnh quá trình thu hút các yếu tố sửa chữa DNA và nối lại đoạn DNA bị cắt. Ngoài ra, khi cấu trúc chromatin bị thay đổi và các protein kéo đến gần đoạn DNA bị cắt, thì cấu hình ngoại di truyền tại vị trí DNA và histon đó cũng bị thay đổi, tạo ra kiểu hình lão hóa. Nhóm Sinclair cho rằng, các yếu tố ngoại di truyền ở chế độ hoạt động khi chúng ta còn trẻ và chuyển dần sang chế độ bất hoạt khi chúng ta già đi. Ý tưởng này đã từng được đề cập cách đây hơn 60 năm bởi tác giả Waddington, ông cho rằng khi còn trẻ, tế bào trong cơ thể có khả năng biệt hóa rất cao, khi cơ thể dần già đi, các thay đổi ngoại di truyền thay đổi khiến cho gen biểu hiện kém đặc hiệu hơn, gây khử-biệt hóa (de-differentiation) và mất chức năng bẩm sinh, dẫn tới già hóa và chết. Bám vào cơ sở lý thuyết này, nhóm Sinclair đã thúc đẩy quá trình thay đổi ngoại di truyền bằng DSB và tìm cách đảo ngược quá trình này qua 3 yếu tố điều hòa phiên mã OSK đã được chứng minh trước đó từ năm 2020. Trong nghiên cứu này, nhóm Sinclair đã mô tả rằng, các hoạt động của OSK tại tế bào hạch võng mạc ở chuột 12 tháng tuổi giúp phục hồi mức mRNA đạt lại ngưỡng như ở chuột trẻ.
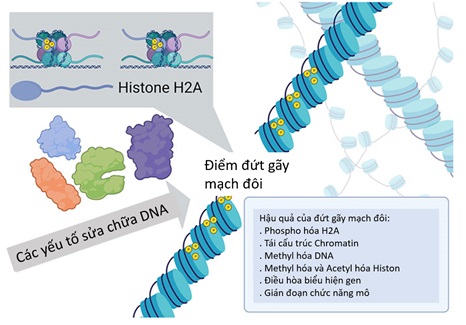
Hình 2. y-H2AX đi đến vị trí đứt gãy mạch đôi và quá trình tái cấu trúc Chromatin gây ra những thay đổi ngoại di truyền.
Tuy nhiên rất khó để phân biệt liệu 3 yếu tố OSK có thành công trong việc tái lập chương trình tất cả các tế bào hay chỉ nhắm tới các tế bào không tổn thương. Thậm chí các nhà khoa học cũng lo ngại nếu 3 yếu tố OSK tái lập chương trình các tế bào có tích lũy đột biến có thể cũng sẽ tạo thành kiểu hình đột biến.Những phát hiện in vitro và in vivo của nhóm Sinclair về thay đổi ngoại di truyền làm tăng tốc độ lão hóa được các nhà khoa học khác đánh giá rất cao. Các kết quả này không chỉ đánh giá dựa trên thay đổi trong phiên mã và ngoại di truyền, mà còn đánh giá dựa trên các hoạt động nhận thức và thể chất của sinh vật. Hơn nữa nhóm Sinclair cũng đánh giá thoái hóa thần kinh và teo cơ trên cả hai mô hình lão hóa tự nhiên và lão hóa tăng cường. Về in vitro, các yếu tố OSK đảo ngược thay đổi biểu hiện gen ở tế bào thần kinh qua biến đổi mô hình methyl hóa DNA và histon về các mô hình tương tự như ở các tế bào trẻ hơn. Hiện tượng đảo ngược các đặc điểm ngoại di truyền và biểu hiện gen này đề ra những chiến lược với mục tiêu trẻ hóa tế bào nhằm sống khỏe mạnh hơn, chứ không chỉ nhắm tới mục đích sống lâu hơn.
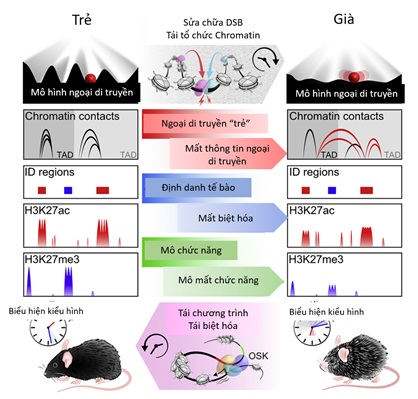
Hình 3. Những thay đổi ngoại di truyền đóng vai trò quan trọng trong quá trình lão hóa.
Những hạn chế của nghiên cứu
Mặc dù có những tiến bộ đáng kể, song nghiên cứu của nhóm Sinclair cũng có những điểm hạn chế. Điểm đầu tiên là mặc dù có đảo ngược quá trình methyl hóa DNA trong tế bào thần kinh cũng như biểu hiện trình tự RNA, nhóm nghiên cứu chưa đưa ra được bất kỳ thay đổi về kiểu hình nào. Mặc dù nhóm nghiên cứu đưa ra các minh chứng rằng mô hình chuột tạo ra thúc đẩy lão hóa bằng các đánh giá hoạt động và nhận thức cũng như hóa mô miễn dịch các mô liên quan, nhưng lại chưa đưa ra được các minh chứng đánh giá khi đảo ngược quá trình lão hóa. Ví dụ như: kỳ vọng sống, những thay đổi về hệ cơ và nhận thức, hoặc thay đổi đặc trưng của tế bào hoặc mô đã được ghi nhận trong các nghiên cứu trước đây. Bên cạnh đó cần có thêm thông tin về các loại tế bào khác bên cạnh tế bào thần kinh, và liệu các yếu tố OSK có tái tạo khác nhau khi so sánh giữa các loại tế bào hay mô khác nhau không. Ví dụ như với các tế bào gan hoặc thận khi tiếp xúc với OSK có trải qua quá trình thay đổi ngoại di truyền giống nhau không? Việc xác định thay đổi ngoại di truyền từng vị trí cụ thể theo từng loại mô khác nhau có ý nghĩa rất lớn để hiểu hơn về bối cảnh trẻ hóa tế bào.
Bên cạnh DSB còn có các dạng tổn thương DNA khác như đứt chuỗi đơn, tái sắp xếp chromosome, tổn thương các bazo do oxy hóa cũng là nguyên nhân gây ra lão hóa thông qua các thay đổi ngoại di truyền, nghiên cứu các tổn thương DNA khác sẽ mang lại góc nhìn đa chiều hơn về quá trình lão hóa tế bào.
Nghiên cứu của nhóm Sinclair đánh dấu một cột mốc quan trọng trong việc đảo ngược chu trình lão hóa, hứa hẹn mang lại nhiều lợi ích cho nhân loại. Hiện tại có thể mong chờ việc nghiên cứu được ứng dụng trên mô hình động vật bậc cao hoặc xa hơn là ứng dụng trên người. Quan trọng nhất là đặt nền tảng cho những nghiên cứu điều trị trong tương lai trên các bệnh liên quan tới tuổi tác như ung thư hoặc huyết áp.
TÀI LIỆU THAM KHẢO
1. https://www.cell.com/cell/fulltext/S0092-8674(22)01570-7, accessed 10 August 2023.
2. https://www.frontiersin.org/articles/10.3389/fragi.2023.1199596/full, accessed 10 August 2023.
3. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7752134/, accessed 10 August 2023.