Sự khởi đầu
Những năm 90 của thế kỷ XX, trong phòng thí nghiệm của mình tại Đại học California (Hoa Kỳ), James P. Allison đã nghiên cứu về protein CTLA-4 của tế bào T. Ông là một trong số ít nhà khoa học thời điểm đó đã đưa ra nhận xét rằng CTLA-4 có chức năng như một “chốt kiểm soát” của các tế bào T (hình 1). Các nhóm nghiên cứu khác đã khai thác cơ chế này như một mục tiêu trong điều trị các bệnh tự miễn. Tuy nhiên, Allison lại có một ý tưởng hoàn toàn khác. Ông đã nghiên cứu và phát triển một loại kháng thể có thể liên kết với CTLA-4 và ngăn chặn chức năng của nó. Sau đó, ông lại nghiên cứu xem xét liệu “khóa” CTLA-4 có thể gỡ bỏ “chốt kiểm soát” tế bào T đồng thời giải phóng hệ thống miễn dịch giúp tấn công các tế bào ung thư hay không. Năm 1994, Allison và các công sự đã đạt được kết quả ngoạn mục trong nghiên cứu của mình khi những con chuột bị ung thư đã được chữa khỏi nhờ điều trị bằng các chất ức chế “chốt kiểm soát” và “mở khóa” hoạt động của tế bào T chống khối u [1].
Trước đó, Tasuku Honjo - nhà miễn dịch học người Nhật Bản đã phát hiện ra PD-1, một loại protein khác được biểu hiện trên bề mặt tế bào T vào năm 1992. Quyết tâm làm sáng tỏ vai trò của nó, ông đã khám phá ra chức năng của PD-1 bằng một loạt các thí nghiệm tỉ mỉ được thực hiện trong nhiều năm tại Đại học Kyoto. Kết quả cho thấy, PD-1 tương tự như CTLA-4, hoạt động như một “chốt kiểm soát” của tế bào T, nhưng theo một cơ chế khác (hình 1). Trong các thí nghiệm trên động vật, việc phong tỏa PD-1 cũng được chứng minh như là một chiến lược đầy hứa hẹn trong cuộc chiến chống ung thư [2, 3]. Với các nghiên cứu trên, hai nhà khoa học này đã được trao Giải Nobel Y học năm 2018. Đây là cơ sở, nền tảng để các công ty nghiên cứu, sản xuất ra nhiều loại thuốc là các kháng thể đơn dòng ức chế các thụ thể CTLA-4 hoặc thụ thể PD1/PD-L1 [1].
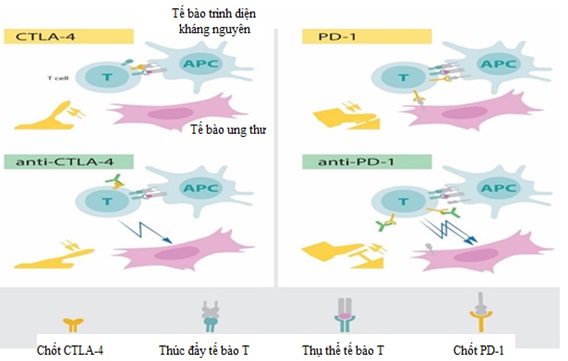
Hình 1. (A): việc kích hoạt tế bào T yêu cầu thụ thể tế bào T cần liên kết với các cấu trúc đặc biệt có trên các tế bào miễn dịch khác (tế bào trình diện kháng nguyên - Antigen Presenting Cell (APC) chủ yếu là các đại thực bào, tế bào đuôi gai, tế bào B) và phải được xác nhận là “lạ”. Một protein hoạt động như một “chất thúc đẩy” cũng cần thiết để kích hoạt tế bào T. Chức năng của CTLA- 4 như một “chốt kiểm soát” các tế bào T, nó ức chế hoạt động của “chất thúc đẩy”. Các kháng thể (màu xanh lá cây) kháng CTLA-4 ngăn chặn chức năng của “chốt kiểm soát” dẫn đến kích hoạt các tế bào T và tấn công các tế bào ung thư. (B): phía trên bên phải: PD-1 như một “chốt kiểm soát” khác, tương tự nó cũng ức chế sự hoạt hóa của tế bào T. Các kháng thể kháng PD-1 ức chế chức năng của “chốt kiểm soát” dẫn đến hoạt hóa tế bào T và tấn công có hiệu quả cao vào tế bào ung thư (nguồn: nobelprize.org).
Cơ chế dần được hé lộ và sự công nhận bước đầu
Nivolumab là một kháng thể đơn dòng (IgG4) hoàn toàn trên người ức chế chốt kiểm soát miễn dịch. Nó liên kết với PD-1, ngăn cản sự tương tác của PD-1 với các phối tử PD-L1 (còn được gọi là B7-H1 hoặc CD274) và PD-L2 (còn được gọi là B7-DC hoặc CD273) [4]. Trong môi trường vi thể, PD-1 và PD-L1 đóng vai trò quan trọng đối với sự tồn tại và phát triển của khối u. Nó giúp khối u thoát khỏi “sự giám sát” đến từ hệ thống miễn dịch. Khái niệm “sự giám sát của hệ miễn dịch” (Immunosurveillance) được dựa trên mô hình do hai nhà khoa học Lewis Thomas (là một bác sĩ, nhà nghiên cứu, nhà văn, nhà quản trị, nhà giáo dục, và cố vấn chính sách người Mỹ) và Frank Macfarlane Burnet (nhà vi-rút học nổi tiếng người Úc) đề xuất vào giữa thế kỷ XX, trong đó nhấn mạnh việc các tế bào miễn dịch đi tuần tra khắp cơ thể để tìm kiếm và tiêu diệt tế bào ung thư ngay khi chúng vừa mới hình thành. Người ta phát hiện rằng, PD-1 được biểu hiện trên nhiều loại tế bào miễn dịch khác nhau, chẳng hạn như bạch cầu đơn nhân, tế bào T, tế bào B, tế bào tua và tế bào lympho thâm nhập khối u (TIL). Ái tính của PD-L1 với PD-1 trên tế bào T khiến cho nó bị rối loạn chức năng, kiệt sức và bị vô hiệu hóa. Sự biểu hiện quá mức của PD-L1 chính là “bản năng” khối u tự bảo vệ khỏi sự tiêu diệt của tế bào T gây độc (CD8+). Do cạn kiệt các tế bào T (CD8+), các tế bào ung thư tích cực tiết ra một số cytokine gây viêm, chẳng hạn như yếu tố hoại tử khối u alpha (TNF-α), interleukin-2 (IL-2) và interferon gamma (IFN-γ). Một số loại tế bào T phụ trợ khác như tế bào T điều hòa (Treg, CD4+) lại góp phần giúp khối u tạo ra một môi trường ức chế miễn dịch cao bằng cách duy trì sự biểu hiện của PD-1 trên bề mặt của chính nó [5]. Do đó, sự tương tác của Nivolumab với PD-1 làm giảm tín hiệu tiêu cực của PD-1/PD-L1, từ đó tăng cường phản ứng miễn dịch kháng khối u của chính vật chủ (hình 2) [4].
Các nghiên cứu tiền lâm sàng đã chứng minh rằng, sự phong tỏa con đường PD-1/PD-L1 qua trung gian kháng thể dẫn đến sự gia tăng số lượng tế bào T (cả tế bào T hiệu lực lẫn tế bào T đặc hiệu kháng nguyên) và điều chỉnh tiết cytokine (các protein hay glyco protein) in vitro và trên động vật thí nghiệm. Trên người, tương tác của Nivolumab với thụ thể PD-1 được đánh giá bằng cách sử dụng tế bào T đã được tinh sạch từ máu ngoại vi. Nivolumab liên kết ái lực cao với PD-1 trên tế bào T nhớ, tế bào Treg (T điều hòa), giúp ngăn cản sự tương tác của nó với PD-L1 và PD-L2. Các tế bào T (CD4+) được kích hoạt có hiệu quả nhất ở nồng độ 0,64 nmol/l [4].
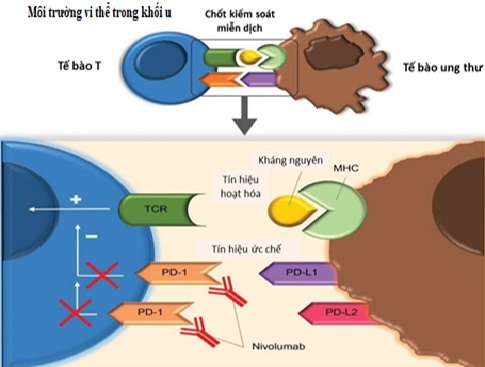
Hình 2. Vai trò điều hòa miễn dịch của thụ thể PD-1 và cơ chế hoạt động của Nivolumab. MHC (Major Histocompatibility Complex) là phức hợp tương thích mô chính; TCR (T-Cell Receptor) là thụ thể tế bào T (nguồn: ncbi.nlm.nih.gov).
Nivolumab được Cơ quan Quản lý dược phẩm châu Âu (EMA) và FDA chấp thuận để điều trị một số bệnh ung thư dưới dạng đơn trị liệu hoặc kết hợp với các liệu pháp điều trị khác (bảng 1). Trong các thử nghiệm lâm sàng về bệnh ung thư, các chỉ tiêu đánh giá thường được sử dụng như: sống thêm toàn bộ (Overall survival - OS), sống thêm không tiến triển (Progression-free survival - PFS), tỷ lệ đáp ứng khách quan (Objective response rate - ORR). Trong đó, OS là thời gian tính từ thời điểm bắt đầu tham gia nghiên cứu (với thử nghiệm LS - nghiên cứu khoa học nhằm xác định can thiệp tốt nhất cho bệnh nhân, đồng thời ghi nhận tất cả những tác hại và lợi ích của can thiệp đó - không ngẫu nhiên) đến thời điểm tử vong do bất kể nguyên nhân nào; PFS là thời gian tính từ thời điểm bắt đầu tham gia nghiên cứu (với thử nghiệm LS không ngẫu nhiên) đến thời điểm bệnh tiến triển hoặc tử vong do bất kể nguyên nhân nào; ORR là tỷ lệ bệnh nhân đạt được mức độ thuyên giảm đã được định nghĩa từ trước. Các thử nghiệm đối với Nivolumab (Opdivo) trên các đối tượng khác nhau đều cho kết quả OS, PFS, ORR rất khả quan. Kết quả cho thấy, hiệu quả hữu hiệu của liệu pháp này trong điều trị nhiều loại ung thư khác nhau. Tuy nhiên, cũng giống như các liệu pháp điều trị khác, các tác dụng phụ của Nivolumab chắc chắn sẽ còn được ghi nhận thêm (có thể nghiêm trọng hoặc thậm chí đe dọa đến tính mạng). Chúng được gây ra bởi những phản ứng miễn dịch hoạt động quá mức nhưng thường thì có thể kiểm soát được. Các nghiên cứu cần được liên tục tiến hành với mức độ chuyên sâu hơn nữa để tập trung vào việc làm sáng tỏ các cơ chế hoạt động. Mục tiêu là cải thiện và giảm tác dụng phụ và tối ưu hóa chi phí điều trị.
Bảng 1. Danh sách các chỉ định của Nivolumab (Opdivo) tính đến 5/2021.
|
Chỉ định
|
Cách dùng
|
Thử nghiệm lâm sàng
|
Cơ quan phê duyệt
|
|
Ung thư tế bào hắc tố (Melanoma)
|
Đơn trị
Kết hợp*
|
CHECKMATE-037 (NCT01721746)
CHECKMATE-066 (NCT01721772)
CHECKMATE-067 (NCT01844505)
CHECKMATE-238 (NCT02388906)
|
FDA
EMA
|
|
Ung thư phổi không tế bào nhỏ di căn (Metastatic Non-Small Cell Lung Cancer)
|
Kết hợp*
|
CHECKMATE-227 (NCT02477826)
CHECKMATE-9LA (NCT03215706)
CHECKMATE-017 (NCT01642004)
CHECKMATE-057 (NCT01673867)
|
FDA
EMA
|
|
U trung biểu mô màng phổi ác tính (Malignant Pleural Mesothelioma)
|
Kết hợp*
|
CHECKMATE-743 (NCT02899299)
|
FDA
|
|
Ung thư biểu mô tế bào thận tiến triển (Advanced Renal cell carcinoma)
|
Đơn trị
Kết hợp*
|
CHECKMATE-214 (NCT02231749)
CHECKMATE-9ER (NCT03141177)
CHECKMATE-025 (NCT01668784)
|
FDA
EMA
|
|
Ung thư Hodgkin cổ điển (Classical Hodgkin Lymphoma)
|
Đơn trị
|
CHECKMATE-205 (NCT02181738)
|
FDA
EMA
|
|
Ung thư biểu mô tế bào vảy ở đầu và cổ (Squamous Cell Carcinoma of the Head and Neck)
|
Đơn trị
|
CHECKMATE-141 (NCT02105636)
|
FDA
EMA
|
|
Ung thư biểu mô đường bài xuất hệ tiết niệu (Urothelial carcinoma)
|
Đơn trị
|
CHECKMATE-275 (NCT02387996)
|
FDA
EMA
|
|
Ung thư đại trực tràng (Colorectal Cancer)
|
Đơn trị
Kết hợp*
|
CHECKMATE-142 (NCT02060188)
|
FDA
|
|
Ung thư biểu mô tế bào gan (Hepatocellular Carcinoma)
|
Đơn trị
Kết hợp*
|
CHECKMATE-040 (NCT01658878)
|
FDA
|
|
Ung thư biểu mô tế bào vẩy thực quản (Esophageal Squamous Cell Carcinoma)
|
Đơn trị
|
ATTRACTION-3 (NCT02569242)
|
FDA
EMA
|
|
Ung thư dạ dày di căn (Metastatic gastric cancer)
|
Kết hợp*
|
CHECKMATE-649 (NCT02872116)
|
FDA
|
*Có thể kết hợp với Ipilimumab (tác dụng cùng cơ chế với Nivolumab nhưng trên CTLA-4) hoặc hóa trị.
Nguồn: tổng hợp từ www.accessdata.fda.gov và www.ema.europa.eu.
Thay lời kết
Với sự tiến bộ của khoa học, chúng ta đã biết thêm về liệu pháp “ức chế chốt kiểm soát miễn dịch", đó là “huy động” chính hệ thống miễn dịch của bệnh nhân để tiêu diệt tế bào ung thư, thay vì cố gắng “đốt cháy”, “đầu độc” hoặc phẫu thuật cắt bỏ chúng ra khỏi cơ thể như trước đây. Liệu pháp này đã làm thay đổi rõ rệt kết quả theo hướng có lợi trên một số nhóm bệnh nhân ung thư (đặc biệt ở giai đoạn cuối). Trong hơn 100 năm qua, các nhà khoa học đã cố gắng can thiệp vào hệ thống miễn dịch và việc sử dụng Nivolumab là liệu pháp quan trọng cung cấp cho các bác sỹ thêm sự lựa chọn trong việc điều trị các bệnh ung thư ở giai đoạn di căn xa.
TÀI LIỆU THAM KHẢO
[1] https://www.nobelprize.org/prizes/medicine/2018/press-release/.
[2] https://www.cancer.gov/publications/dictionaries/cancer-terms/def/nivolumab.
[3]https://www.fda.gov/news-events/press-announcements/fda-approves-first-immunotherapy-initial-treatment-gastric-cancer.
[4] Giulia Zago, et al. (2016), New targeted treatments for non-small-cell lung cancer - role of nivolumab, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4975160/.
[5] Hashem O. Alsaab, et al. (2017), PD-1 and PD-L1 checkpoint signaling inhibition for cancer immunotherapy: mechanism, combinations, and clinical outcome, https://www.frontiersin.org/articles/10.3389/fphar.2017.00561/full#h4.