Một vài nét về protein trị liệu
Protein được thiết kế để sử dụng như một dược phẩm/thuốc được gọi là protein trị liệu, hay thuốc protein sinh học (biologics). Protein là cơ sở/nền tảng của sự sống và việc sử dụng thuốc protein/protein trị liệu đã có một lịch sử lâu dài. Protein trị liệu truyền thống được phân lập như các hợp chất xuất hiện tự nhiên từ động vật, thực vật, vi sinh vật... Hiện nay, nhiều dạng thuốc protein sinh học mới được tạo ra bằng công nghệ DNA tái tổ hợp.
Hiện có khoảng 239 protein trị liệu và 380 biến thể thuốc đã được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê chuẩn [1]. Thông tin về mỗi protein/peptide bao gồm không chỉ về trình tự, cấu trúc, tính chất hóa học, mà còn về lĩnh vực bệnh tật, phương thức hoạt động, dược lực học, lộ trình điều trị, độc tính, đích tác động của chúng. Nhiều loại protein hoặc peptide khác nhau đã được FDA phê duyệt cho sử dụng trong lâm sàng và nhiều loại khác còn đang trong quá trình nghiên cứu phát triển [2, 3]. Sự phát triển mạnh mẽ các protein trị liệu trong những năm gần đây là do đặc điểm/lợi thế của chúng so với các loại thuốc phân tử nhỏ. Đầu tiên, đó là do tính đa dạng về cấu trúc, các protein thường sở hữu một tập hợp các chức năng rất đặc biệt và phức tạp mà các hợp chất hóa học đơn giản không thế có. Thứ hai, bởi vì hoạt động của protein rất đặc hiệu, thường ít có khả năng liệu pháp protein can thiệp vào các quá trình sinh học bình thường và gây ra tác dụng phụ. Thứ ba, một cách tự nhiên, cơ thể có thể sản xuất nhiều protein được sử dụng làm thuốc trị liệu, các tác nhân này thường được dung nạp tốt và ít có khả năng kích thích các phản ứng miễn dịch. Thứ tư, đối với các bệnh lý trong đó gen bị đột biến hoặc bị mất đoạn, protein trị liệu có thể là liệu pháp thay thế hiệu quả mà không cần liệu pháp gen (gene therapy), hiện chưa thể sẵn sàng ứng dụng cho hầu hết các rối loạn di truyền. Thứ năm, sự phát triển/thử nghiệm lâm sàng và thời gian phê duyệt của FDA về liệu pháp protein có thể nhanh hơn so với thuốc phân tử nhỏ. Cuối cùng, do mỗi loại protein đều có cấu trúc và chức năng riêng biệt/tương ứng, các công ty có thể có được sự bảo hộ bằng sáng chế sâu rộng cho liệu pháp protein. Hai lợi thế cuối cùng làm cho protein trở nên hấp dẫn hơn từ quan điểm tài chính so với các thuốc phân tử nhỏ.

Hình 1. Biểu đồ về số lượng thuốc hóa học và thuốc sinh học mới được FDA phê duyệt trong hai thập kỷ qua [4].
Phân loại phân tử và chức năng
Protein trị liệu khác nhau ở nhiều khía cạnh so với các loại thuốc phân tử nhỏ/hóa học truyền thống. Chúng khác nhau không chỉ về kích thước, thành phần, phương thức sản xuất, độ tinh sạch, tác dụng phụ, sự ổn định, công thức, mà còn ở các khía cạnh pháp lý... Những khác biệt cơ bản này lý giải cho việc các thuốc protein sinh học được xem xét như một nhóm thuốc/dược phẩm đặc biệt, với nhiều đặc tính chung khác với các thuốc phân tử nhỏ. Protein trị liệu có thể được phân loại dựa trên các thể loại phân tử như: kháng thể đơn dòng, cytokine, hormon, enzym, vắc xin, các yếu tố máu, kháng sinh peptide... Cũng do sự đa dạng về cấu trúc và chức năng, có nhiều cách phân loại các protein trị liệu hiện hành hoặc đang được phát triển.
Dựa trên vai trò hoặc phương thức hoạt động, các protein trị liệu được phân thành 4 nhóm khác nhau. Nhóm I bao gồm các protein có hoạt tính enzym hoặc điều hòa. Nhóm II gồm các protein có khả năng gắn đích đặc hiệu/cụ thể. Nhóm III là các protein sử dụng tạo vắc xin. Nhóm IV bao gồm các protein sử dụng trong chẩn đoán (hình 2).
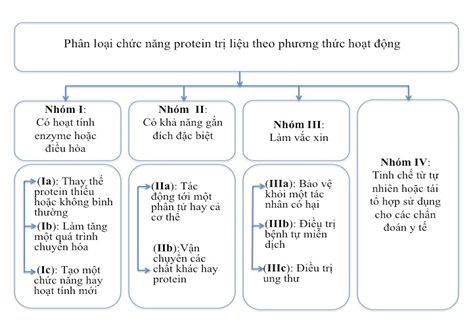
Hình 2. Sơ đồ phân loại protein và peptide trị liệu dựa trên hoạt tính và chức năng của chúng [3].
Dựa trên hoạt động/hoạt tính dược lý, các protein trị liệu được chia thành 5 nhóm: (i) Thay thế một loại protein bị thiếu hoặc bất thường; (ii) Gia tăng một quá trình chuyển hóa hiện có; (iii) Cung cấp một chức năng hoặc hoạt động mới; (iv) Can thiệp vào một phân tử hoặc cơ thể; (v) Vận chuyển/cung cấp các hợp chất hoặc protein khác, chẳng hạn như một hạt nhân phóng xạ, thuốc gây độc tế bào...
Ngoài ra, các protein trị liệu cũng có thể được chia nhóm dựa trên cấu trúc phân tử của chúng, bao gồm thuốc được thiết kế dựa trên kháng thể, protein dung hợp với Fc, thuốc chống đông máu, protein hình thái xương, protein được thiết kế hình dàn (scaffold), enzym, hormon, interleukin... Chúng cũng có thể được phân loại dựa trên cơ chế hoạt động ở mức phân tử là: (i) Liên kết không cộng hóa trị với đích gắn (mAbs); (ii) Tác động đến liên kết cộng hóa trị (enzym); (iii) Tác động mà không có tương tác cụ thể (Albumin huyết thanh).
Hầu hết các protein trị liệu hiện có trên thị trường là tái tổ hợp và hàng trăm trong số chúng đang trong quá trình thử nghiệm lâm sàng để điều trị ung thư, rối loạn miễn dịch, nhiễm trùng... Các protein được thiết kế mới, bao gồm BisAbs (bispecific mAbs), protein dung hợp đa yếu tố, mAbs liên kết với các loại thuốc phân tử nhỏ và protein với dược động học được tối ưu hóa hiện đang được phát triển.
Ngoài các protein trị liệu dựa trên sinh vật nhân chuẩn, một số protein/enzym trị liệu dựa trên sinh vật nhân sơ cũng đã được phát triển, sản xuất và ứng dụng lâm sàng. Ví dụ, L-asparaginase (một loại enzym hóa trị liệu), methionine gamma-lyase (một tác nhân chống ung thư tiềm năng), L-glutaminase (một loại enzym chống thiếu máu) và L-methionase (tham gia xây dựng các phân tử protein khác và tổng hợp axit amin L-cysteine) là những protein đang được sử dụng phổ biến nhất trong điều trị các bệnh khác nhau.
Công nghệ và sản xuất protein trị liệu
Công nghệ/kỹ thuật protein là loại công nghệ mới, có thể tổng hợp các protein không tồn tại trong tự nhiên thông qua thiết kế phân tử và công nghệ DNA tái tổ hợp ở cấp độ gen. Trong những năm gần đây, công nghệ protein đã được áp dụng ngày càng rộng rãi trong lĩnh vực dược phẩm sinh học, và được đánh giá có triển vọng ngày càng lớn. Phát triển và sản xuất protein trị liệu là một quá trình phức tạp liên quan đến không chỉ tái tổ hợp gen mã hóa cho sản phẩm protein trị liệu, xác minh hệ thống (vector) biểu hiện mạnh, đặc tính của hệ thống biểu hiện tế bào chủ ổn định, mà còn là tối ưu hóa và thiết kế hệ thống lên men nuôi cấy tế bào động vật có vú và phát triển một quá trình phục hồi hiệu quả tạo ra sản lượng, chất lượng sản phẩm cao. Protein trị liệu bao gồm cả các kháng thể đơn dòng cũng như protein có kích thước lớn hơn (có trọng lượng phân tử thậm chí vượt quá 100 kDa) so với các loại thuốc phân tử nhỏ. Ngoài ra, protein trị liệu còn có các cấu trúc bậc hai và bậc ba phức tạp phải được duy trì để đảm bảo hoạt tính đặc hiệu. Do vậy, protein trị liệu không thể tổng hợp hoàn toàn bằng các quá trình hóa học mà phải được sản xuất trong các tế bào/cơ thể sống hoặc trong các hệ thống đặc biệt. Cách lựa chọn về dòng tế bào, nguồn gốc loài và điều kiện nuôi cấy đều ảnh hưởng đến các đặc tính sản phẩm cuối cùng.
Do sự phức tạp của protein trị liệu liên quan đến kích thước phân tử lớn, biến đổi/sửa đổi sau dịch mã và sự đa dạng của các vật liệu sinh học liên quan đến quá trình sản xuất của chúng, để tăng cường các thuộc tính/chức năng đặc biệt trong khi phải duy trì hiệu quả và an toàn sản phẩm đạt được cần có các chiến lược thiết lập công nghệ/kỹ thuật cho mỗi loại hay một nhóm protein điều trị tương ứng. E. coli, S. cerevisiae và P. pastoris đều đã được chứng minh là những vật chủ vi sinh vật có thể được sử dụng để sản xuất nhiều loại protein trị liệu khác nhau nhờ có cấu trúc đơn giản, không bao gồm những biến đổi sau dịch mã. Với các protein cần có các biến đổi sau dịch mã (đặc biệt là quá trình glycosyl hóa), để giữ được cấu trúc và hoạt tính đặc hiệu, chúng được thiết kế và biểu hiện ở các tế bào động vật nuôi cấy. Nhiều protein trị liệu tái tổ hợp (như β-interferon, yếu tố VIII và erythropoietin) đã được thiết kế và sản xuất thành công nhờ sử dụng tế bào buồng trứng của chuột đồng Trung Quốc. Những nền tảng này thường được chọn để sản xuất protein phức tạp nhằm cung cấp liệu pháp protein (thuốc sinh học) trong lĩnh vực công nghệ sinh học.
Do môi trường nuôi cấy tế bào động vật phức tạp, tốn kém, công nghệ biến đổi gen đang thu hút sự chú ý nhiều hơn cho việc sản xuất các loại protein điều trị khác nhau bằng cách sử dụng động vật biến đổi gen. Bên cạnh đó, nhiều cây/thực vật chuyển gen cũng đã được sử dụng để sản xuất các loại protein trị liệu khác nhau. Sau khi sản xuất, các protein điều trị này được tinh chế bằng các kỹ thuật khác nhau.
Cũng cần phải nhắc đến hệ thống tổng hợp protein không có tế bào (cell-free protein synthesis - CFPS) như là một công cụ khá đơn giản, nhanh chóng, không có rào cản liên kết màng nhưng chứa tất cả các chất nền sinh học và bộ phận cần thiết để tổng hợp các protein in vitro mong muốn [5]. CFPS có khả năng khắc phục những thiếu sót trong các hệ thống sản xuất in vivo hiện tại và là một công cụ đầy hứa hẹn trong cả nghiên cứu cơ bản và ứng dụng. Nó có thể được sử dụng để mở rộng mã di truyền, lắp ráp virus và trong kỹ thuật trao đổi chất để sản xuất các protein phức tạp. Các hệ thống CFPS đang nổi lên như một công nghệ mạnh mẽ để sản xuất protein nói chung, bao gồm cả protein/enzym trị liệu thông lượng cao.
Nhu cầu ngày càng tăng về protein điều trị là một động lực cho sự phát triển các công nghệ nền (platform technologies) có thể được áp dụng cho nhiều loại sản phẩm theo cùng một cách. Một loạt công nghệ nền phục vụ/hỗ trợ cho kỹ thuật protein hiện đang được sử dụng với mục tiêu tăng thời gian bán hủy, hạn chế độc tính, tăng hiệu quả và chức năng của các loại thuốc protein trị liệu mới cũng như tăng năng suất sản xuất sản phẩm [6]. Ví dụ, phương pháp glycosyl hóa protein, các phương pháp tiếp hợp (conjugation) và dẫn xuất hóa protein hiện đang được sử dụng để kéo dài thời gian bán hủy của thuốc [7]. Thời gian bán hủy dài hơn in vivo có tầm quan trọng đặc biệt đối với bệnh nhân đang phải điều trị thay thế các yếu tố máu/enzym/hormon, trong đó chế độ dùng thuốc thường xuyên có thể dẫn đến tác động tiêu cực đáng kể đến sức khỏe của bệnh nhân.
Thị trường về protein trị liệu
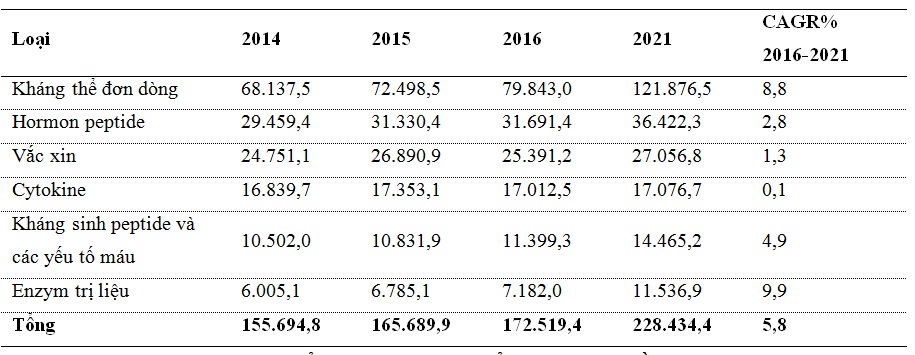
Protein trị liệu hiện đã được xác định là nhóm thuốc sinh học quan trọng cả về mặt lâm sàng và thương mại. Công nghệ DNA tái tổ hợp thực sự đã làm thay đổi thị trường này. Trong hai thập kỷ qua, người ta đã chứng kiến sự gia tăng đáng kể không chỉ về số lượng các protein tái tổ hợp mà còn ở cách ứng dụng chúng trong điều trị bệnh ở mức độ lâm sàng. Thuốc protein sinh học đã mang lại một sự thay đổi đáng chú ý trong ngành y tế. Chúng đã cho thấy tầm quan trọng trong việc phục vụ nhân loại trước sự gia tăng các bệnh mạn tính như tim mạch, tự miễn dịch, hen suyễn, bệnh đa xơ cứng... Thị trường toàn cầu về thuốc protein sinh học năm 2015 đạt gần 165,7 tỷ USD đã được dự đoán đạt trên 228 tỷ USD vào năm 2021 và khoảng 300 tỷ USD vào năm 2026, tốc độ tăng trưởng hàng năm (CAGR) tương ứng là 5,8 và 8,4% [8, 9] (bảng 1).
Bảng 1. Thị trường toàn cầu cho các loại thuốc protein sinh học đến năm 2021 (triệu USD) [8].
Đã hơn ba thập kỷ kể từ khi kháng thể đơn dòng đầu tiên - muromonab-CD3 (orthoclone OKT3) được FDA phê duyệt vào năm 1986 [10], công nghệ/kỹ thuật kháng thể đã phát triển vượt bậc. Các loại thuốc kháng thể hiện nay ngày càng có ít tác dụng phụ do tính đặc hiệu cao của chúng. Do đó, các kháng thể trị liệu đã trở thành nhóm thuốc mới chiếm ưu thế trong những năm gần đây. Trong 5 năm qua, kháng thể đã trở thành loại thuốc bán chạy nhất trên thị trường dược phẩm. Năm 2018, 8/10 loại thuốc bán chạy nhất trên toàn thế giới là thuốc sinh học. Nhiều công ty công nghệ sinh học đã phát triển và sản xuất các kháng thể như “viên đạn ma thuật” chống ung thư đã được tung ra thị trường. Thị trường toàn cầu về kháng thể đơn dòng trị liệu có giá trị xấp xỉ 115,2 tỷ USD vào năm 2018 và dự kiến doanh thu sẽ tăng hàng trăm tỷ USD vào năm 2025 [11]. Thị trường về kháng thể trị liệu đã có sự phát triển bùng nổ như những thuốc mới được phê duyệt để điều trị các bệnh khác nhau ở người, bao gồm cả bệnh ung thư, tự miễn, chuyển hóa và các bệnh truyền nhiễm.
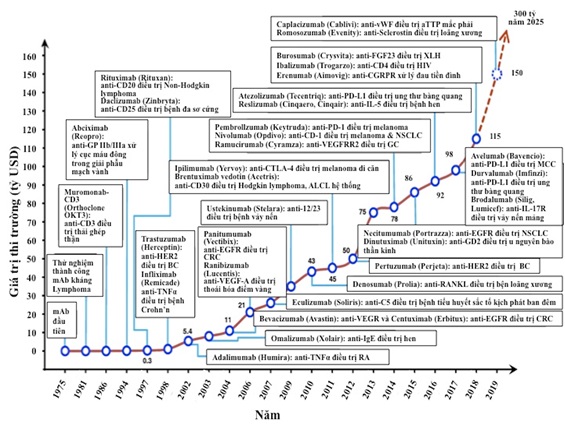
Hình 3. Biểu đồ phát triển các kháng thể trị liệu và ứng dụng giai đoạn 1975-2019 [11].
Chiều cao của dòng và chú thích bằng số biểu thị giá trị thị trường ước tính của kháng thể đơn dòng (mAb) trị liệu (được hiển thị theo tỷ đô la Mỹ); Ab: kháng thể; ALCL: u lympho tế bào lớn không phân biệt hệ thống; aTTP: ban xuất huyết giảm tiểu cầu huyết khối mắc phải; BC: ung thư vú; CD: cụm biệt hóa; CGRP: peptide liên quan đến gen calcitonin; CGRPR: thụ thể peptide liên quan đến gen calcitonin; CRC: ung thư đại trực tràng; CTLA-4: protein 4 liên quan tế bào lympho T gây độc; EGFR: thụ thể yếu tố tăng trưởng biểu bì; FGF: thụ thể yếu tố tăng trưởng nguyên bào sợi; GC: ung thư dạ dày; GD2: disialoganglioside GD2; HER2: thụ thể 2 yếu tố tăng trưởng biểu bì người; IgE: immunoglobulin E; IL: interleukin; IL-17R: thụ thể interleukin-17; mAb: kháng thể đơn dòng; MCC: ung thư biểu mô tế bào Merkel; NSCLC: ung thư phổi không phải tế bào nhỏ; PD-1: protein 1 lập trình tế bào chế; PD-L1: ligand 1 lập trình chết; TNFα: yếu tố alpha hoại tử khối u; RA: viêm khớp dạng thấp; RANKL: chất kích hoạt thụ thể của phối tử yếu tố kappa-B nhân; VEGF-A: yếu tố A tăng trưởng nội mô máu; VEGFR2: thụ thể 2 yếu tố A tăng trưởng nội mô máu; vWF: yếu tố von Willebrand; XLH: X-linked hypophosphatemi bệnh giảm phosphate liên kết X.
Thuốc protein sinh học đã và đang được sử dụng để điều trị các bệnh mạn tính như tiểu đường, hen suyễn, ung thư, rối loạn máu, rối loạn sinh sản, rối loạn miễn dịch và nội tiết tố. Có sự gia tăng tỷ lệ mắc các bệnh này trong những năm gần đây do những thay đổi trong lối sống và thói quen ăn uống. Chính sự gia tăng tần suất của các bệnh mạn tính này cũng như sự gia tăng tỷ lệ ung thư là động lực thúc đẩy thị trường mở rộng các loại thuốc protein sinh học.
Ngành công nghiệp protein trị liệu là một trong những thị trường dược phẩm sinh học rộng lớn và đang phát triển nhanh chóng trên toàn cầu. Có rất nhiều công ty dược phẩm sinh học đang tiến vào lĩnh vực dược phẩm protein và một số trong đó đang dẫn đầu các sản phẩm chuyên biệt trong các danh mục khác nhau. Các công ty đang nỗ lực phát triển các liệu pháp điều trị mới để chống lại các bệnh như tiểu đường và ung thư bằng cách khám phá các sản phẩm thuốc tân tiến và hiệu quả. Đáng chú ý trong thị trường thuốc protein sinh học là các công ty AbbVie Inc., Amgen Inc., Baxter International Inc. (Baxter Health Corp), Bayer AG (Bayer Health Corp), Biogen Idec, CSL Behring Ltd, Eli Lilly và Co., GlaxoSmithKline...
Theo nhận định của các chuyên gia, thị trường thuốc protein sinh học sẽ tiếp tục tăng do luôn có sự phát hiện các phân tử thuốc protein sinh học tái tổ hợp mới, mang lại các tiêu chuẩn tốt hơn cho hệ thống chăm sóc sức khỏe. Ngoài ra, do dược phẩm tái tổ hợp tốt hơn thuốc hóa học, thị trường đang được phát triển linh hoạt đối với tất cả các quốc gia, đặc biệt là với các nước phát triển.
Thay lời kết
Lĩnh vực y dược hiện đang trên đà chuyển đổi từ liệu pháp hóa học phân tử nhỏ sang liệu pháp sinh học bao gồm protein trị liệu, liệu pháp gen và tế bào. Do tính trung tâm của protein đối với chức năng sinh học, công nghệ protein được cho là một trong những công nghệ quan trọng để phát triển những liệu pháp sinh học mới nổi này. Nhờ những tiến bộ trong nhiều lĩnh vực khác nhau (sinh học phân tử, tin sinh học, kỹ thuật xử lý các quá trình sinh học), trong hai thập kỷ qua, cùng với công nghệ protein và enzym, chúng ta cũng đang chứng kiến sự dịch chuyển mạnh mẽ từ sản phẩm protein trị liệu nguyên bản/tự nhiên có nguồn gốc khác nhau sang các protein trị liệu được sản xuất in vivo hoặc in vitro với trình tự và cấu trúc được thiết kế phù hợp theo định hướng phát triển và thị trường ngày càng tăng về các dược phẩm này. Các protein trị liệu chất lượng cao đã và đang được phát triển, phê duyệt và ứng dụng rộng rãi trong lâm sàng cho cả những bệnh nan y như ung thư, bệnh tự miễn/viêm nhiễm, hay các rối loạn di truyền… Tuy vậy, do có tính đặc hiệu về cấu trúc, chức năng, cũng như phương thức hoạt động, nhiều yếu tố quan trọng (bao gồm cả tính hướng đích, kiểm soát thời gian bán hủy và miễn dịch sinh học...) cần được xem xét nghiêm túc trong quy trình/công nghệ sản xuất, tinh chế và xây dựng các công thức cho mỗi loại protein trị liệu khác nhau để có chất lượng tốt hơn, đảm bảo sự an toàn và hiệu quả của các dược phẩm đặc biệt này.
* Bài báo được hoàn thành với sự hỗ trợ của đề tài “Xây dựng bản đồ công nghệ Protein và Enzym” (mã số ĐM.43.DA/19).
TÀI LIỆU THAM KHẢO
[1] Database of FDA - approved peptide and protein therapeutics, http://crdd.osdd.net/ raghava/ thpdb/.
[2] B.G. De La Torre, F. Albericio (2020), “The pharmaceutical industry in 2019: an analysis of FDA drug approvals from the perspective of molecules”, Molecules, 25(3), DOI: 10.3390/molecules25030745.
[3] S.S. Usmani, et al. (2017), “THPdb: database of FDA-approved peptide and protein therapeutics”, PLOS ONE, 12(7), p.0181748.
[4] A. Mullard (2019), “FDA drug approvals”, Nat. Rev. Drug. Discov., 19, pp.79-84.
[5] S.K. Dondapati, et al. (2020), “Cell-free protein synthesis: a promising option for future drug development”, Bio.Drugs, 34(3), pp.327-348.
[6] M.R. Nejadmoghaddam, et al. (2019), “Antibody-drug conjugates: possibilities and challenges”, J. Med. Biotechnol., 11(1), pp.3-23.
[7] S.C. Mehta, et al. (2019), “Protein conjugates and fusion proteins as ocular therapeutics”, Drug Discov. Today, 24(8), pp.1440-1445.
[8] BCC Research (2017), Global markets for bioengineered protein drugs.
[9] Global Protein Therapeutics Market Analysis (2019), https://www.Researchandmarkets.com/reports/4857806/global-protein-therapeutics-market-analysis-2019.
[10] D.M. Ecker, et al. (2015), “The therapeutic monoclonal antibody market”. Mabs, 7, pp.9-14.
[11] R.M. Lu, et al. (2020), “Development of therapeutic antibodies for the treatment of diseases”, J. Biomed Sci., 27, DOI: 10.1186/s12929-019-0592-z.