Di truyền biểu sinh là gì?
Di truyền biểu sinh (hay di truyền ngoại gen - Epigenetics) đã phát triển từ một tập hợp các hiện tượng phức tạp không thể giải thích được bằng cơ chế di truyền học, trở thành một lĩnh vực nghiên cứu quan trọng, độc lập và có ảnh hưởng sâu rộng. Phần lớn nghiên cứu di truyền biểu sinh ngày nay tập trung vào các biến đổi trong cấu trúc hóa học của DNA, bao gồm quá trình methyl hóa DNA và các biến đổi hóa học của đuôi protein histone. Các dấu hiệu biểu sinh kết nối và tương tác với nhau một cách có hệ thống, đảm bảo sự cân bằng nội môi của tế bào cũng như duy trì biểu hiện gen đúng trong quá trình sinh trưởng và phát triển ở người. Bên cạnh đó, nghiên cứu về di truyền biểu sinh, đặc biệt là “hồ sơ” methyl hóa DNA (methylome), cho thấy rằng quá trình thay đổi methylome trong giai đoạn biệt hóa tế bào góp phần thiết yếu tạo ra sự đặc trưng cho từng loại mô/tế bào. Các tổ hợp đặc trưng của những methylome này được gọi với thuật ngữ “toàn bộ hệ gen biểu sinh” (epigenome) để phân biệt với “toàn bộ hệ gen” (genome). Bằng việc cung cấp các kiến thức nền tảng, những nghiên cứu liên quan đến di truyền ngoại gen cũng đã mở ra nhiều cơ hội phát triển và ứng dụng, đặc biệt là trong y học.
Ứng dụng nổi bật trong phát hiện bệnh truyền nhiễm
Trong các tế bào soma, quá trình methyl hóa diễn ra ở khoảng 90% các cytosine tại các vị trí CpG, quan trọng hơn hết, tỷ lệ này khác nhau giữa các loại mô, tế bào và tình trạng bệnh khác nhau. Một số tác nhân gây bệnh, chẳng hạn như vi rút gây suy giảm miễn dịch ở người (HIV) và vi rút viêm gan B (HBV) đã được xác minh là có thể làm thay đổi sự điều hòa methyl hóa DNA của vật chủ [1, 2]. Mycobacterium tuberculosis (Mtb) gây bệnh lao phổi và coronavirus 2 (SARS-CoV-2) gây ra hội chứng hô hấp cấp tính nặng, những nguyên nhân gây tử vong hàng đầu trên thế giới, cũng đã được chứng minh là có các tính chất nêu trên. Năm 2020, A.R. DiNardo và cs [3] phát hiện ra rằng, mức độ methyl hóa của các gen liên quan đến miễn dịch thay đổi, dẫn đến sự kích hoạt các phản ứng miễn dịch của vật chủ chống lại Mtb. Các nghiên cứu trên bệnh nhân nhiễm COVID-19 cũng cho thấy những thay đổi về methyl hóa DNA có liên quan đến hoạt động của hệ thống miễn dịch, qua đó kích hoạt tế bào B và tế bào T nhằm chống lại sự xâm nhiễm của vi rút. Những phát hiện này chỉ ra rằng, hiện tượng methyl hóa DNA rất quan trọng trong quá trình tiến triển ở bệnh truyền nhiễm và có thể đóng vai trò là dấu ấn sinh học đầy hứa hẹn.
Các yếu tố ngoại di truyền, bao gồm quá trình methyl hóa DNA, được xem như nhân tố giải thích sự tương tác giữa quá trình xâm nhiễm của mầm bệnh và hệ miễn dịch của vật chủ. Trong đại dịch COVID-19, tình trạng thiếu hụt các cơ sở chăm sóc y tế đã thúc đẩy nhu cầu xác định sớm những bệnh nhân có nguy cơ diễn biến nặng. Trước nhu cầu đó, một nghiên cứu trên quần thể 407 bệnh nhân COVID-19 đã chỉ ra 44 vùng CpG cho thấy sự khác biệt về methyl hóa DNA giữa nhóm bệnh nhân có triệu chứng và không có triệu chứng [4]. Từ phát hiện này, mô hình EPICOVID được xây dựng và cho kết quả dự đoán tốt (AUC=0.92). Tuy nhiên, việc sử dụng quá nhiều chỉ thị sinh học trong nghiên cứu trên cũng tạo ra những rào cản nhất định trong ứng dụng lâm sàng. Do đó, trong thời gian gần đây, TS.BS Trần Nguyễn Trọng Phú và cs đã thực hiện một nghiên cứu về sự thay đổi methyl hóa DNA trên quần thể 1.700 người bao gồm các bệnh nhân COVID-19 có diễn tiến nặng và nhẹ dựa vào thông số “COVID-GRAM” hoặc “WHO Ordinal Scale” [5] (hình 1). Trong nghiên cứu này, mô hình COVID-19 Methylation Risk Score (gọi tắt là COMER score) được xây dựng, cho thấy khả năng phân loại tốt nhóm bệnh nhân có nguy cơ diễn tiến nặng (AUC=0.83) khi chỉ sử dụng giá trị methyl hóa của 3 vị trí CpG.
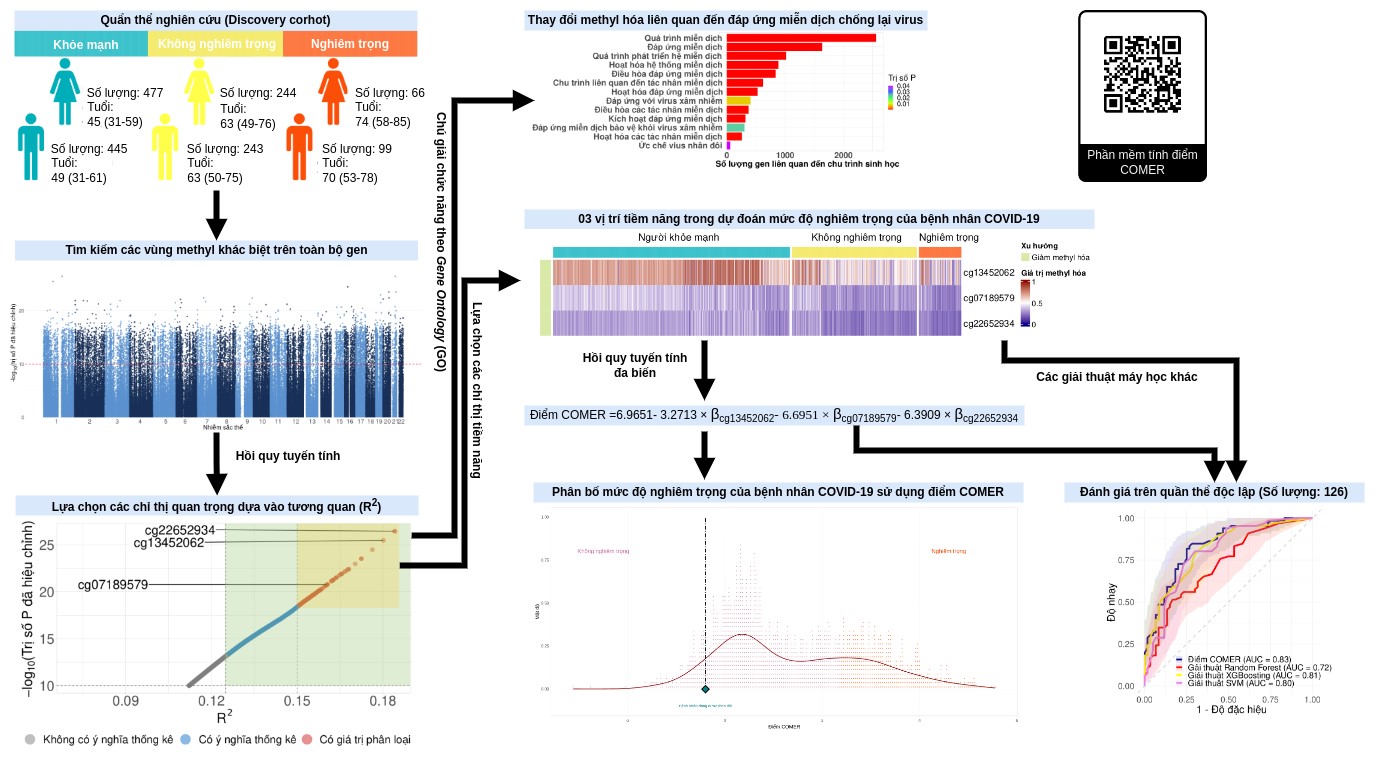
Hình 1. Sự thay đổi methyl hóa DNA trên quần thể bệnh nhận COVID-19 dựa vào thông số COVID-GRAM hoặc “WHO Ordinal Scale” [5].
Tiên lượng, chẩn đoán sớm và theo dõi điều trị ung thư
Bản chất phức tạp và đa yếu tố của ung thư được xem là một thách thức lớn đối với việc chẩn đoán, tiên lượng và theo dõi điều trị. Trong những năm gần đây, việc nghiên cứu quá trình thay đổi của hệ gen biểu sinh trong ung thư đã tạo ra một bước tiến mới trong chẩn đoán, tiên lượng và điều trị ung thư, đặc biệt là các phương pháp không xâm lấn bằng sinh thiết lỏng.
GSTP1 là thành viên của họ enzyme Glutathione-S transferases (GSTs) đóng vai trò quan trọng trong nhiều chu trình tế bào và là gen ức chế ung thư. Quá trình thay đổi methyl hóa DNA, cụ thể là sự tăng biểu hiện methyl của gen GSTP1, được xem như là một dấu ấn sinh học tiềm năng trong chẩn đoán và tiên lượng trong ung thư tuyến tiền liệt. Năm 2019, Mahon và cộng sự [6] đã thực hiện một thử nghiệm lâm sàng (giai đoạn III) trên quần thể 600 bệnh nhân nhằm mục đích tìm ra mối quan hệ giữa mGSTP1(methylated GSTP1) tự do trong huyết thanh và kết quả của phác đồ hóa trị với docetaxel. Kết quả cho thấy, mGSTP1 tự do ở huyết thanh sau điều trị docetaxel có quan hệ chặt chẽ với tỷ lệ sống sót của bệnh nhân mCRPC. Bên cạnh đó, nhiều nghiên cứu cũng cho thấy, tiềm năng sử dụng mGSTP1 trong chẩn đoán và tiên lượng các loại ung thư khác như ung thư biểu mô tế bào gan (HCC) và ung thư vú.
Năm 2022, R. Pidsley và cs đã thực hiện một nghiên cứu theo dõi trên quần thể bệnh nhân tại Bệnh viện St Vincent’s (Úc) [7] nhằm tìm ra các dấu ấn biểu sinh tiềm năng trong tiên lượng cho bệnh nhân ung thư tuyến tiền liệt. Nghiên cứu này đã phân tích sự khác biệt methyl hóa DNA giữa các nhóm bệnh nhân có khả năng sinh tồn khác nhau (ung thư tuyến tiền liệt gây chết (lethal) và không gây chết (non-lethal). Dựa trên các phân tích này, mô hình tiên lượng “18-gene” được xây dựng, cho thấy mối liên quan chặt chẽ giữa tỷ lệ tử vong do ung thư tuyến tiền liệt và hiện tượng tăng biểu hiện DNA methylation của các gen trong mô hình. Các phân tích khác cũng cho thấy tiềm năng ứng dụng của mô hình này cho phép can thiệp sớm hơn và cải thiện kết quả điều trị của bệnh nhân trong tương lai.
Trong những năm gần đây, sinh thiết lỏng là phương pháp tiềm năng trong việc giảm đến mức tối thiểu các kỹ thuật thu mẫu bệnh phẩm xâm lấn nhằm nâng cao chất lượng cuộc sống cho bệnh nhân trong quá trình điều trị ung thư. Tuy nhiên, giải pháp này gặp nhiều thách thức khi phải cung cấp được dữ liệu methyl hóa DNA có độ chính xác cao từ mẫu bệnh phẩm có chất lượng tương đối thấp. Trên cơ sở phát triển các dấu ấn sinh học trong chẩn đoán ung thư vú bằng giá trị methyl hóa DNA thông qua mẫu sinh thiết lỏng, TS Lưu Phúc Lợi và các cộng sự tại Phòng thí nghiệm nghiên cứu di truyền biểu sinh thuộc Viện Nghiên cứu Y Khoa Garvan, Sydney, Úc đã thực hiện các phân tích trên quần thể bệnh nhân ung thư vú. Kết hợp với các phương pháp máy học, mô hình được phát triển trong nghiên cứu này cho thấy khả năng phân loại bệnh nhân ung thư vú bằng phương pháp không xâm lấn (AUC=0.91).
Hỗ trợ nghiên cứu và phát triển liệu pháp điều trị ung thư
Liệu pháp biểu sinh (epigenetic therapy) là thuật ngữ dùng để chỉ phương pháp sử dụng các cơ chế di truyền biểu sinh nhằm thay đổi biểu hiện của các gen có chức năng quan trọng trong chu trình tế bào. Thời gian gần đây, các liệu pháp biểu sinh hứa hẹn khả năng đặc biệt có thể giúp khắc phục tình trạng kháng thuốc trong các phác đồ điều trị ung thư thường quy, cũng như hướng tới phát triển các liệu pháp trong y học chính xác và y học cá thể hóa.
Như đã đề cập, các cơ chế điều hòa thông qua quá trình methyl hóa DNA được xúc tác bởi các thành viên của họ enzyme DNMT như DNMT1, DNMT3A/B. Nghiên cứu cho thấy, các khối u có xu hướng suy giảm giá trị methyl hóa DNA trung bình trên toàn bộ hệ gen, tuy nhiên, ở các vùng điều hòa như promoter lại cho thấy sự tăng giá trị methyl hóa dẫn đến việc giảm biểu hiện của các gen ức chế khối u. Trên cơ sở đó, các tác nhân gây giảm methyl hóa DNA (hypomethylation agents) như decitabine (DAC) và azacitidine (5-AZA) ra đời với mục đích ức chế hoạt tính của DNMT. Các tác nhân này gắn với chuỗi DNA, cản trở DNMT gắn nhóm methyl vào vị trí CpG, dẫn đến sự suy giảm methyl hóa.
Năm 2015, một nghiên cứu về ung thư đại tràng trên mô hình chuột cho thấy, sự tái biểu hiện của gen NALP1 đóng vai trò quan trọng trong các “chu trình chết” của tế bào như apoptosis, pyroptosis sau khi mô hình chuột này trải qua phác đồ sử dụng DAC. Nhóm nghiên cứu này cũng nhận định rằng, biểu hiện của NALP1 có liên quan đến khả năng sống sót và quá trình di căn của bệnh nhân ung thư đại tràng. Các nghiên cứu thử nghiệm lâm sàng gồm DACO-016 và DACO-017 trên các bệnh nhân bạch cầu dòng tủy cấp tính (AML) cũng cho thấy sự cải thiện đáng kể trong khả năng sống sót của bệnh nhân ở mọi độ tuổi. Bên cạnh AML, các bệnh nhân mang hội chứng loạn sản tủy, bệnh bạch cầu tủy đơn nhân mãn tính cũng được khuyến cáo sử dụng các tác nhân làm giảm methyl hóa DNA như là phương pháp thay thế cho các bệnh nhân không đủ điền kiện điều trị chuyên sâu như ghép tế bào gốc hay hóa trị liệu. Ngoài khả năng tái biểu hiện các gen ức chế khối u, DAC và 5-Aza cũng được chứng minh có tác động tăng cường hệ miễn dịch chống lại ung thư thông qua hoạt hóa IFNγ+ tế bào T, tế bào Th1, và tế bào T độc ở cả mô hình in vivo và in vitro (hình 2).
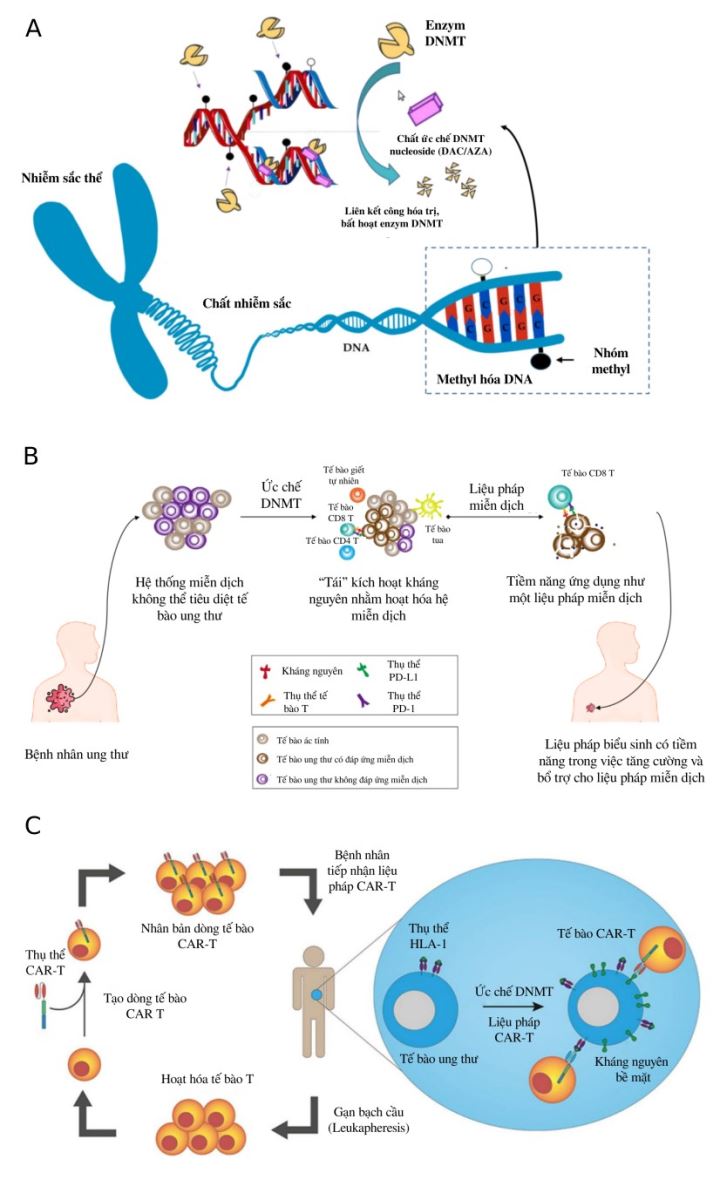
Hình 2. Cơ chế hoạt động của chất ức chế DNMT (nhóm nucleoside) (A). Liệu pháp miễn dịch kết hợp liệu pháp biểu sinh mở ra các cơ hội mới trong điều trị ung thư (B). Sự tái biểu hiện của “Kháng nguyên ung thư/tinh hoàn” bằng chất ức chết DNMT tạo nền tảng cho Liệu pháp tế bào CAR-T (C).
Bên cạnh đó, việc xác định các gen và kháng nguyên đặc hiệu trong ung thư đóng vai trò quan trọng trong việc nghiên cứu phát triển các dấu ấn đặc trưng cho liệu pháp miễn dịch và vắc-xin ung thư. Các nghiên cứu gần đây chỉ ra rằng, quá trình thay đổi methyl hóa DNA diễn ra trong giai đoạn hình thành khối u có liên quan đến biểu hiện vượt mức của các “kháng nguyên ung thư/tinh hoàn” [8]. Các gen này được biểu hiện một cách có chọn lọc trong tinh hoàn và hiếm khi biểu hiện trong các mô khác. Do đó, việc các gen này có biểu hiện vượt mức trong các khối u tạo ra những chỉ thị hứa hẹn trong các liệu pháp miễn dịch. Hơn nữa, việc tái biểu hiện của nhóm gen “Kháng nguyên ung thư/tinh hoàn” có thể được kích hoạt một cách chủ động bằng việc làm giảm methyl hóa DNA thông qua các chất ức chế DNMT.
Mặc dù các chất ức chế DMNT cho thấy nhiều hứa hẹn trong liệu pháp ung thư, nhưng các thực nghiệm lâm sàng chỉ ra rằng chỉ 50% bệnh nhân có đáp ứng với chất ức chế DNMT và phần lớn bệnh nhân bị tái phát sau 2 năm. Điều này cho thấy sự cần thiết trong việc kết hợp liệu pháp di truyền biểu sinh với các liệu pháp ung thư khác. Bên cạnh đó, kết quả này cũng cho thấy tầm quan trọng của thời gian cũng như liều lượng của các thuốc ức chế DNMT trong phác đồ điều trị. Mặc dù vẫn còn đang trong giai đoạn thử nghiệm, các thuốc ức chế DNMT đã cho thấy nhiều tiềm năng đối với các loại ung thư phức tạp có xu hướng kháng các liệu pháp hiện tại.
*
* *
Mặc dù hệ gen biểu sinh và các nghiên cứu liên quan đến hệ gen biểu sinh là một khái niệm cũng như một ngành nghiên cứu tương đối mới, tuy nhiên thực tế đã cho thấy nhiều tiềm năng mà lĩnh vực nghiên cứu này mang lại trong việc cung cấp các kiến thức sinh học nền tảng, cũng như các ứng dụng thực nghiệm lâm sàng trong tương lai.
TÀI LIỆU THAM KHẢO
[1] R.N. Bogoi, A. Pablo, E. Valencia, et al. (2018), "Expression profiling of chromatin-modifying enzymes and global DNA methylation in CD4+ T cells from patients with chronic HIV infection at different HIV control and progression states", Clin. Epigenetics, 10, DOI: 10.1186/s13148-018-0448-5.
[2] Y. Okamoto, K. Shinjo, Y. Shimizu, et al. (2014), "Hepatitis virus infection affects DNA methylation in mice with humanized livers", Gastroenterology, 146(2), pp.562-572, DOI: 10.1053/j.gastro.2013.10.056.
[3] A.R. DiNardo, K. Rajapakshe, T. Nishiguchi, et al. (2020), "DNA hypermethylation during tuberculosis dampens host immune responsiveness", J. Clin. Invest., 130(6), pp.3113-3123, DOI: 10.1172/JCI134622.
[4] M.C. Moura, V. Davalos, L.P. Serra, et al. (2021), "Epigenome-wide association study of COVID-19 severity with respiratory failure", EBioMedicine, 66, DOI: 10.1016/j.ebiom.2021.103339.
[5] T.N.T. Phu, T.B. Thien, L.V. Hieu, et al. (2023), “Establishment of ‘COMER’ - A DNA methylation-based risk score to predict COVID-19 infection severity”, https://covidpre.shinyapps.io/comerscore/, accessed 15 January 2024.
[6] K.L. Mahon, W. Qu, H.M. Lin, et al. (2019), "Serum free methylated glutathione S-transferase 1 DNA levels, survival, and response to docetaxel in metastatic, castration-resistant prostate cancer: Post Hoc analyses of data from a phase 3 trial", Eur. Urol., 76(3), pp.306-312, DOI: 10.1016/j.eururo.2018.11.001.
[7] R. Pidsley, D. Lam, W. Qu, et al. (2022), "Comprehensive methylome sequencing reveals prognostic epigenetic biomarkers for prostate cancer mortality", Clin. Transl. Med., 12(10), DOI: 10.1002/ctm2.1030.
[8] D. Li, L. Xia, P. Huang, et al. (2023), "Serine protease PRSS56, a novel cancer-testis antigen activated by DNA hypomethylation, promotes colorectal and gastric cancer progression via PI3K/AKT axis", Cell Biosci., 13, DOI: 10.1186/s13578-023-01060-0.