ASO và cơ chế hoạt động
ASO là các oligonucleotide tổng hợp hoặc các chất tương tự oligonucleotide có thể được thiết kế để liên kết với các RNA mã hóa protein cũng như các RNA không mã hóa. ASO bản chất là các chuỗi axit nucleic (DNA hoặc RNA) sợi đơn ngắn (dài khoảng 12 đến 25 nucleotide [1]. ASO đã được sửa đổi về mặt hóa học để khắc phục những vấn đề này. Chúng điều chỉnh chức năng RNA thông qua nhiều cơ chế khác nhau, tùy thuộc vào loại sửa đổi hóa học, vị trí sửa đổi và vị trí gắn kết mà chúng nhắm mục tiêu RNA. Hơn nữa, ASO có thể được thiết kế để điều chỉnh quá trình xử lý các phân tử RNA, bao gồm điều hòa quá trình cắt nối RNA và lựa chọn các vị trí polyadenylation để phá vỡ cấu trúc của RNA. Điều này được sử dụng để ức chế quá trình dịch mã của protein và thúc đẩy sự phân hủy RNA [2].
Khoảng 4 thập kỷ trước, Zamecnik và Stephenson lần đầu tiên báo cáo rằng các ASO sợi đơn tổng hợp có thể bất hoạt quá trình dịch mã khi nhắm vào mục tiêu mRNA của virus sarcoma Rous [3]. Sau một số nghiên cứu toàn diện, các nhà khoa học đã xác định rằng cơ chế của ASO tổng hợp có thể bao gồm 2 loại bao gồm phân cắt RNA và phong tỏa RNA.
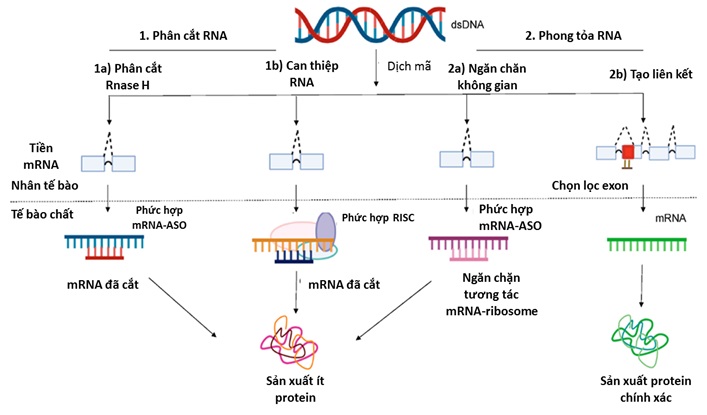
Cơ chế hoạt động của ASO (Nguồn: mdpi.com).
Cơ chế đầu tiên là phân cắt RNA 1(a). Dị hợp tử ASO-mRNA thu thập enzyme RNase H1 và enzyme này sẽ cắt mRNA mục tiêu. ASO nhắm mục tiêu vào RNA, tạo thành các dị hợp tử ASO-RNA, đóng vai trò là cơ chất cho enzyme RNase có trong tế bào chất. RNase làm suy giảm RNA trong heteroduplex 1(b). Sự phân hủy mARN bởi siRNA liên quan đến phức hợp im lặng cảm ứng RNA (RISC/RNA-inducing silencing complex). Cơ chế thứ 2 là phong tỏa RNA 2(a). Phức hợp ASO-mRNA ngăn chặn cả về không gian và sự tương tác của mRNA với ribosome1 để dịch mã protein. Các lớp ASO này liên kết với trình tự RNA đích và làm dừng quá trình dịch mã bằng cách ức chế sự tương tác của chúng với tiểu đơn vị 40S của ribosome hoặc ngăn chặn sự lắp ráp của chúng trên tiểu đơn vị 40S hoặc 60S của ribosome. Trong hình, giai đoạn 2(b) là một ví dụ về oligonucleotide (Oligonucleotides là những phân tử DNA hoặc RNA ngắn, được tạo thành từ sự kết nối của nhiều tiểu phân tử nucleotide) chuyển mạch mối nối (SSO). Cơ chế phân tách qua trung gian RNase H1, can thiệp RNA và cản trở không gian tạo ra ít protein hơn, trong khi quá trình điều biến mối nối tạo ra dạng protein chính xác [1-4].
Tiềm năng ứng dụng của ASO trong y học cá thể
Hiện tại không có phương pháp chữa trị triệt để cho hầu hết các bệnh lý di truyền hiếm gặp. Tuy nhiên, sự ra đời của các liệu pháp antisense sẽ mang lại hy vọng mới cho những bệnh nhân không may mắc phải những căn bệnh này. Một trong những bệnh lý phức tạp đầu tiên được điều trị với ASO là chứng loạn dưỡng cơ Duchenne (DMD/Duchenne muscular dystrophy) và gần đây là bệnh lý tích tụ lipofuscin2. DMD là một rối loạn di truyền hiếm gặp liên quan đến nhiễm sắc thể X và có ảnh hưởng đến khoảng 6.000 bé trai mới sinh trên toàn thế giới mỗi năm [5]. Nó được gây ra bởi những đột biến vô nghĩa của gen dystrophin3.
Những đột biến có hại này (xóa, chèn và đột biến điểm, dẫn đến dịch chuyển khung hình và sự xuất hiện của một codon/mã di truyền kết thúc sớm) dẫn đến sự vắng mặt hoàn toàn của dystrophin. Đột biến đã được tìm thấy ở tất cả các exon, nhưng exon từ 47 đến 63 thường bị ảnh hưởng nhất. Sản xuất dystrophin bị lỗi gây hậu quả nghiêm trọng trên các bệnh nhân này. Thực tế, trẻ em và thanh niên mắc chứng DMD dần dần phát triển những rối loạn nghiêm trọng về thần kinh cơ. Họ mất khả năng đi lại, sau đó mắc các vấn đề về tim mạch, hô hấp và tổn thương các cơ của đường tiêu hóa. Tất cả những triệu chứng này dẫn đến cái chết sớm của bệnh nhân. Có những dạng loạn dưỡng khác thường ít nghiêm trọng hơn DMD, chẳng hạn như chứng loạn dưỡng Becker. Đối với Becker, protein dystrophin biến đổi được tạo ra vẫn duy trì một phần chức năng [6]. Các triệu chứng ở những bệnh nhân mắc chứng loạn dưỡng Becker rất đa dạng. Những bệnh nhân bị nặng nhất có các triệu chứng tương tự như những bệnh nhân mắc chứng DMD, nhưng một số bệnh nhân hầu như không có triệu chứng. Mặc dù giới y học đã nhiều năm nghiên cứu về những căn bệnh này, nhưng hiện nay vẫn chưa thể điều trị được. Hầu hết xác phương pháp điều trị hiện tại nhằm mục đích làm chậm quá trình tiến triển của bệnh và bảo tồn càng nhiều sợi cơ càng tốt.
Gần đây, các nhà khoa học đã thiết kế ASO để tạo ra kiểu hình giống Becker ở bệnh nhân DMD. Bằng cách loại trừ chủ động các exon mang đột biến có hại, có thể tạo ra protein bị cắt ngắn một phần chức năng. Trong tình huống này, các ASO liên kết với tiền mRNA tại vị trí nối của exon bị đột biến. Một chế phẩm có tên là eteplirsen đã được FDA (Cơ quan Thực phẩm và Dược phẩm Mỹ) chấp thuận vào năm 2016 và là ASO thế hệ thứ 3. Bệnh lý tích tụ lipofuscin ở neuron 7 (CLN7) là một rối loạn di truyền gen lặn hiếm gặp ảnh hưởng đến hệ thần kinh, với độ tuổi trung bình của khởi phát là 3,3 tuổi và có thể gây tử vong. Một dạng ASO đã được phát triển cho bệnh này đã được chứng minh là giúp giảm rõ rệt các cơn động kinh. Các bằng chứng này đã khẳng định mạnh mẽ cách ASO có thể được sử dụng như một thành phần của y học cá thể hóa [7].
Các liệu pháp nhắm mục tiêu đã tạo ra một cuộc cách mạng trong quản lý và điều trị ung thư, bằng cách nhắm trực tiếp vào các bất thường di truyền đóng vai trò chính trong sự phát triển của khối u. ASO là công cụ đặc biệt hữu hiệu trong điều trị ung thư vì tính linh hoạt trong hoạt động của chúng. Như đã nêu trên, chúng có thể được sử dụng để giảm biểu hiện của các trình tự mã hóa gây ung thư và có thể nhắm vào các RNA không mã hóa. Tuy nhiên, bất chấp nhiều nỗ lực và một số thử nghiệm khả quan, hiện chưa có chế phẩm ASO nào được chính thức cấp phép lưu hành để điều trị ung thư.
*
* *
Với sự phát triển ấn tượng của các kỹ thuật sinh học phân tử kèm theo sự hiểu biết ngày càng chi tiết về các cơ chế sinh lý bệnh đã tạo ra một xu hướng mới trong y học. Xu hướng này chính là y học cá thể hóa. Trong bối cảnh này, ASO là công cụ mạnh nhắm trực tiếp vào RNA. Thông qua một loạt các nghiên cứu tiên phong, ASO có thể được sử dụng để điều trị nhiều bệnh do các biến đổi gen phức tạp gây ra. Các bệnh này rất hiếm gặp và hiện chưa có phương pháp điều trị hiệu quả. ASO cung cấp tính linh hoạt cao trong việc sử dụng, nhắm mục tiêu các RNA mã hóa và không mã hóa, với cơ chế hoạt động đa dạng. ASO có thể được sử dụng đơn trị liệu hoặc kết hợp với các phương pháp thông thường. Có thể khẳng định, ASO có tiềm năng rất lớn trong việc “điều trị các bệnh không thể điều trị”.
1 Ribosome là một bộ máy phân tử lớn và phức tạp, có mặt trong tất cả các tế bào sống.
2 Sắc tố màu nâu còn sót lại sau sự phân hủy và hấp thụ của các tế bào máu bị hư hỏng, ở neuron 7 (CLN7/neuronal ceroid lipofuscinosis 7).
3 Một loại protein cấu trúc của cơ vân đóng vai trò thiết yếu trong việc duy trì tính toàn vẹn của cơ).
TÀI LIỆU THAM KHẢO
[1] K. Dhuri, et al. (2020), “Antisense Oligonucleotides: An Emerging Area in Drug Discovery and Development”, J. Clin. Med., 9, DOI: 10.3390/jcm9062004.
[2] M. Mansoor, A.J. Melendez (2008), “Advances in antisense oligonucleotide development for target identification, validation, and as novel therapeutics”, Gene Regulation and Systems Biology, 2, pp.275-295.
[3] S. Huang, et al. (2022), “Nonviral delivery systems for antisense oligonucleotide therapeutics”, Biomater Res, 26(49), DOI: 10.1186/s40824-022-00292-4.
[4] M.L. Stephenson P.C. Zamecnik (1978), “Inhibition of Rous sarcoma viral RNA translation by a specific oligodeoxyribonucleotide”, Proc. Natl. Acad. Sci., 75, pp.285-288, DOI: 10.1073/pnas.75.1.285.
[5] K. Bushby, et al. (2010), “Diagnosis and management of Duchenne muscular dystrophy, part 1: Diagnosis, and pharmacological and psychosocial management”, The Lancet Neurology, 9(1), pp.77-93, DOI: 10.1016/S1474-4422(09)70271-6.
[6] K.M.D. Bushby, et al. (1993), “The clinical, genetic and dystrophin characteristics of Becker muscular dystrophy”, Journal of Neurology, 240(2), pp.105-112. DOI: 10.1007/BF00858726.
[7] J.R. Mendell, (2016), “Longitudinal effect of eteplirsen versus historical control on ambulation in Duchenne muscular dystrophy”, Annals of Neurology, 79(2), pp257-271. DOI: 10.1002/ana.24555.