Cơ chế tác động của MF đến tế bào sống
Ứng dụng khoa học vật lý trong sinh học được xem là một trong những chìa khóa quan trọng giúp giải quyết những vấn đề cấp bách mà những nghiên cứu chuyên ngành sinh học không thể giải quyết được. Xuất phát từ việc sinh trưởng và phát triển của thực vật luôn bị ảnh hưởng bởi MF trái đất (50-60 μT), một giả thuyết đã được đặt ra về vai trò của các MF mạnh nhằm kích thích tăng trưởng ở cây trồng. Từ đó, các nhà khoa học đã phân tích ảnh hưởng của MF đến quá trình sinh lý diễn ra trong cây trồng trong điều kiện in vitro và in vivo, đặc biệt là cải thiện năng suất, chất lượng và tăng cường khả năng chống chịu điều kiện bất lợi [1, 2].
Trong cơ thể sống, MF tác động đến tế bào do tính nhuận từ của các bào quan. Cơ chế ảnh hưởng của MF đến sinh giới được giả thuyết theo hai mô hình, là cộng hưởng ion - xyclotron và mô hình cặp gốc (radical-pair) [3]. Thứ nhất, lý thuyết về cộng hưởng ion - xyclotron được giải thích là do các ion chuyển động trong một mặt phẳng vuông góc với MF bên ngoài có tần số Lamor, không gian này có thể gây nhiễu bởi trường điện từ xoay chiều. Theo đó, MF có thể làm thay đổi dòng ion trao đổi qua các màng sinh học trong tế bào, gây ra những tác động hai chiều (tùy vào cường độ) về áp suất thẩm thấu [4]. Một dẫn chứng điển hình của việc MF làm thay đổi quá trình trao đổi ion qua màng là sự tăng cường hấp thu nước ở hạt có xử lý MF. Theo đó, phản ứng thủy phân diễn ra nhanh hơn ở các hạt giống được xử lý MF, đồng thời các enzyme như α-amylase và nitrate reductase cũng được tăng cường, từ đó thúc đẩy quá trình nảy mầm [2].
Ngoài ra, tế bào sống cảm nhận và phản ứng với MF liên quan đến các phản ứng hóa học gây ra trong tế bào thông qua cơ chế cặp gốc. Thông thường, một số phản ứng diễn ra trong tế bào có sự tham gia của enzyme xúc tác liên quan đến các cặp gốc tự do, nghĩa là khi phân tử cảm ứng ánh sáng, các electron có thể nhảy sang phân tử xung quanh, tạo ra các cặp phân tử với electron độc thân (cặp gốc). Nếu các electron trong cặp gốc có cùng trạng thái spin dẫn đến phản ứng hóa học diễn ra chậm hơn và ngược lại. Như vậy, MF với cường độ khác nhau (mạnh hơn nhiều so với MF tự nhiên của trái đất) có thể ảnh hưởng trực tiếp đến trạng thái spin của electron, làm biến đổi tốc độ phản ứng hóa học, từ đó làm thay đổi các quá trình sinh lý liên quan.
Một giả thuyết khác về ảnh hưởng của MF đến thực vật là hiện tượng sắt từ thông qua tác động trực tiếp của MF lên hạt sắt, hợp chất sắt khoáng (như Fe3O4 và Fe3S4) và các protein chứa sắt. Các chất dự trữ sắt ở thực vật tồn tại trong tế bào dưới dạng tinh thể magnetit (Fe3O4), ε-Fe2O3 và hematit (α-Fe2O3), chúng có thể tương tác mạnh với MF [5]. Những hạt này cũng có thể ảnh hưởng đến các gốc tự do tạo ra superoxide, vì vậy có thể tác động đến tế bào theo cả hai hướng.
Sử dụng MF kích thích sinh trưởng và phát triển của cây trồng
Các nghiên cứu đã ghi nhận tác dụng của MF trong việc kích thích quá trình nảy mầm sớm của hạt giống, cải thiện tỷ lệ nảy mầm của một số loại cây trồng [6]. Cụ thể, tăng cường độ từ trường tĩnh (SMF) từ 87 đến 226 mT tỷ lệ thuận với khả năng nảy mầm và lượng nước hấp thụ của hạt đậu xanh (Vigna radiata). Phơi nhiễm hạt chanh dây (Passiflora edulis) với 200 mT SMF cũng kích thích nảy mầm và sức sống cây non. Hạt đậu gà (Cicer arietinum) xử lý SMF từ 50 đến 150 mT cho thấy sự cải thiện về tốc độ nảy mầm, chiều dài cũng như trọng lượng khô của cây con. Những tác động tích cực đến tỷ lệ nảy mầm của hạt và đặc tính nông sinh học của cây non cũng được ghi nhận trong hạt dưa chuột (Cucumis sativus) giống Barsati xử lý SMF 200 mT, ngô (Zea mays) giống HQPM-1 xử lý SMF 200 mT, cà chua (Solanum lycopersicum) giống MST/32 xử lý SMF 50-332 mT, củ cải (Raphanus sativus) xử lý SMF 8-20 mT… (bảng 1). Các nghiên cứu cho thấy, xử lý MF thích hợp làm giảm H+ trong thành tế bào, tăng cường khả năng hấp thụ nước trong hạt, ngăn chặn quá trình ngủ đông. Hơn nữa, phân tích chuyển hóa cho thấy một số enzyme phân giải, như α-amylase và protease được giải phóng mạnh để phân giải các chất dinh dưỡng trong nội nhũ, kích thích trao đổi chất của tế bào mô phân sinh ở hạt, dẫn đến thúc đẩy quá trình nảy mầm của hạt. Hạt giống cây trồng xử lý trong môi trường MF cũng làm tăng khả năng hấp thụ và trao đổi ion qua các màng sinh học, từ đó kích thích quá trình chuyển hóa các chất trong tế bào.
Bảng 1. Ảnh hưởng của MF đến sinh trưởng và phát triển của một số cây trồng.
|
Loài
|
Cơ quan/bộ phận
|
Cường độ MF
|
Tác động
|
|
Vigna radiata
|
Hạt
|
SMF 87-226 mT
|
Tăng tốc độ và tỷ lệ nảy mầm trung bình
Tăng hấp thụ nước vào hạt
|
|
Passiflora edulis
|
Hạt
|
SMF 200 mT
|
Kích thích nảy mầm, tăng sức sống cây non
|
|
Cucumis sativus
|
Hạt
|
SMF 200 mT
|
Tăng tỷ lệ nảy mầm, tăng hoạt tính enzyme thủy phân, enzyme chống ôxy hóa trong suốt giai đoạn nảy mầm
|
|
Glycine max
|
Hạt/cây non
|
SMF 150-200 mT
|
Tăng phản ứng quang hợp
Kích thích nảy mầm, tăng năng suất, tăng tổng hợp sắc tố
Tăng sinh khối, kích thích chuyển hóa N và hình thành nốt sần
|
|
Cicer arietinum
|
Hạt/cây non
|
SMF 50-150 mT
|
Tăng tốc độ và tỷ lệ nảy mầm trung bình
Kích thích sinh trưởng cây non và các đặc tính của rễ
|
|
Triticum aestivum
|
Hạt/cây non
|
SMF 4-7 mT
|
Kích thích nảy mầm và sinh trưởng của cây non
|
|
Solanum lycopersicum
|
Hạt
|
SMF 50-332 mT
|
Tăng tỷ lệ nảy mầm, kích thích điều hòa H2O2, tăng tỷ lệ sống của hạt
|
|
Zea mays
|
Hạt/cây non
|
SMF 200 mT
|
Kích thích nảy mầm và sinh trưởng cây non, tăng hoạt tính enzyme α-amylase và protease
|
|
Raphanus sativus
|
Hạt
|
SMF 8-20 mT
|
Kích thích nảy mầm và sức sống của hạt
|
|
Capsicum annuum
|
Hạt/cây non
|
SMF 57-60 mT
|
Cải thiện nảy mầm và sinh trưởng cây non, năng suất và chất lượng quả
|
|
Hordeum vulgare
|
Hạt/cây non
|
SMF 35 mT
|
Tăng cường nảy mầm hạt và sức sống cây non trong điều kiện thường và xử lý mặn
|
|
Helianthus annuus
|
Hạt/cây non
|
SMF 50-200 mT
|
Tăng tốc độ nảy mầm và sức sống của cây non
|
|
Oryza sativa
|
Rễ/cây
|
MF 125-250 mT
|
Tăng cường chiều dài thân và rễ, tăng cường quá trình nảy mầm của hạt
|
Bên cạnh đó, MF đã được chứng minh giúp cây trồng cải thiện khả năng kháng/chống chịu điều kiện bất thuận thông qua việc giảm thiểu sự tích lũy của các dạng ôxy phản ứng (ROS) [7]. Cụ thể, xử lý hạt dưa chuột với SMF giúp tăng hoạt tính của các enzyme chống ôxy hóa, như superoxide dismutase 8%, catalase 83% và glutathione reductase 77%. Tương tự, sự gia tăng của enzyme catalase và peroxidase ascorbate cũng được ghi nhận ở mẫu atisô (Cynara scolymus) và ngô khi đặt trong MF. Thông qua cải thiện hệ thống enzyme chống ôxy hóa ở rễ và chồi, sử dụng MF cũng được báo cáo giúp tăng khả năng chống chịu hạn trên giống đậu tương JS-335, giống ngô HQPM-1 và đậu lăng (Lens culinaris). Tuy nhiên, MF ở các cường độ không thích hợp lại gây ra những ảnh hưởng không mong muốn đến sinh trưởng của cây trồng. Ví dụ, xử lý cây cà chua với MF trong thời gian ngắn (10 phút), mRNA liên quan đến bất lợi (calmodulin, protein kinase phụ thuộc Ca và chất ức chế proteinase) có thể bị tích lũy nhanh chóng, gây hại cho tế bào và cơ thể.
Đến nay, rất nhiều nghiên cứu đã ghi nhận xử lý MF có thể giúp giảm bớt những tổn thương do điều kiện bất lợi phi sinh học, chẳng hạn như đất nhiễm mặn, chiếu tia UV-B và thiếu nước (hình 1). Xử lý hạt cà chua với SMF giúp tăng tỷ lệ và tốc độ nảy mầm, cây non thể hiện ưu thế về chiều dài thân, đường kính rễ, diện tích lá, trọng lượng tươi và khô trong điều kiện mặn so với đối chứng không xử lý SMF. Tương tự, xử lý SMF cũng có thể làm tăng khả năng nảy mầm của hạt và sức sống của cây đậu xanh, lúa mạch và ngô trong điều kiện đất có nồng độ muối cao hoặc nhiễm kim loại nặng. Xử lý hạt giống đậu tương JS-335 với SMF giúp tăng số lượng nốt sần và sinh khối trong điều kiện xử lý mặn. SMF đã tác động đến con đường chuyển hóa C và N, do đó giúp cải thiện năng suất (tăng số lượng và trọng lượng hạt) trong cả điều kiện thường và xử lý mặn. Bên cạnh đó, xử lý hạt đậu tương với SMF cũng làm tăng cường tổng hợp sắc tố quang hợp. Do đó, hiệu quả của hệ thống quang hóa II tăng rõ rệt trong điều kiện hạn. Một số nghiên cứu khác cho rằng, SMF làm giảm tích lũy của ROS nội bào, hạn chế tác động của bất lợi ôxy hóa đến các bào quan [7].
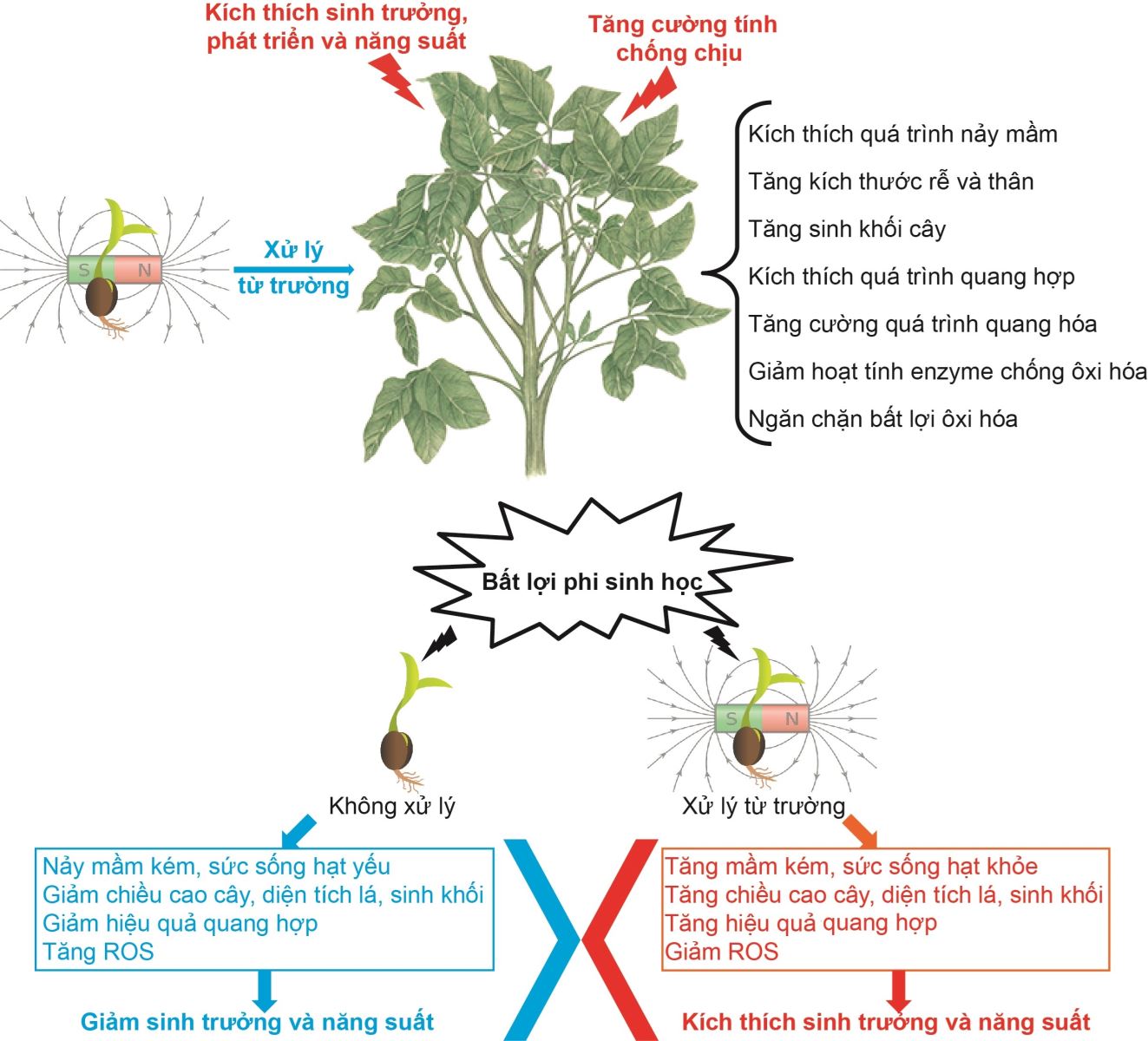
Hình 1. Ứng dụng của MF trong kích thích sinh trưởng, phát triển và năng suất của cây trồng.
Ứng dụng MTW nhằm kích thích sinh trưởng và phát triển của cây trồng
Một trong những ứng dụng của MF là xử lý MTW làm nước tưới tiêu cho trồng trọt. MTW có tác dụng tương tự như MF trong việc thúc đẩy sinh khối và cải thiện đặc tính chống chịu của cây trồng.
Từ hóa dung dịch nước tưới làm thay đổi các đặc tính cơ bản như: độ hoạt động của ion, pH, lực căng bề mặt, tăng hiệu ứng phân cực, dẫn đến tăng sự hấp thụ nước vào tế bào [8]. Ví dụ, chăm sóc cà tím (S. melomgena) giống Florida High Bush bằng MTW làm tăng khả năng hấp thụ nước của cây gấp 1,65 lần, trong khi tưới dung dịch MTW lên giống cà chua Logaen và giống đậu faba (Vicia faba) Isban cũng làm tăng lượng nước hấp thụ lên tương ứng 1,70 và 1,88 lần.
Các nghiên cứu khác đã ghi nhận tác dụng của MTW làm tăng lượng P trong lá cây có múi, trong khi xử lý hạt giống lúa mì NR-234 (vốn có khả năng sống thấp, ~45%) với MTW làm tăng tỷ lệ nảy mầm của hạt và cải thiện sức sống cây con. Hơn nữa, đất canh tác được tưới bằng MTW thể hiện sự khác biệt về nồng độ Ca, P, N, K, Na và Mg so với nước thông thường. Điều này nghĩa là MTW đã làm giảm tính lắng của các hợp chất khoáng. Một tác dụng khác của MTW là giảm độ pH trong đất, kéo theo việc bộ rễ hấp thụ chất dinh dưỡng hiệu quả hơn. Tưới MTW giúp cây đậu Hà Lan (Pisum sativum) và cần tây (Apium tombolens) hấp thụ Ca và P tốt hơn, đồng thời giảm tích lũy Na+ ở các cơ quan trên mặt đất. Những kết quả này đặt ra giả thuyết: sử dụng MTW có thể giúp tăng cường tính kháng mặn của cây trồng thông qua việc hạn chế hấp thụ Na+ vào rễ. Giả thuyết này được khẳng định khi sử dụng nước muối đã từ hóa để tưới cho hai loài Moringa (Moringa oleifera và M. peregrina), cây đã hạn chế được hiện tượng sinh trưởng kém (úa lá), vốn do sự tích lũy Na+ trong mô tế bào. Tưới nước biển từ hóa cho loài Silybum marianum cũng hạn chế được tác hại của mặn đến sinh trưởng ở giai đoạn cây non và ngăn chặn được các bất lợi ôxy hóa xảy ra trong tế bào.
Thay lời kết
Có thể thấy rằng, MF có tiềm năng ứng dụng trong nghiên cứu thực vật và phục vụ sản xuất nông nghiệp. Mặc dù cơ chế tác động của MF đến quá trình sinh lý ở thực vật vẫn chưa thực sự sáng tỏ, nhưng rõ ràng MF có thể kích thích sự sinh trưởng, phát triển và tăng sinh khối của cây trồng. Vì vậy, xử lý MF được xem là một trong những biện pháp kỹ thuật triển vọng áp dụng cho canh tác trong tương lai bởi một số yếu tố sau:
Thứ nhất, xử lý MF có thể giúp hạt giống có tỷ lệ nảy mầm và sức sống cây non tốt. MF (như SMF và MTW) cải thiện khả năng kháng/chống chịu điều kiện bất thuận ở cây trồng. Đồng thời, MF giúp tăng hàm lượng các chất dinh dưỡng trong cây, thúc đẩy quá trình chuyển hóa, dẫn đến làm tăng sinh khối cây trồng. Tuy nhiên, xử lý MF không hợp lý cũng có thể gây ra những kìm hãm nhất định đến sinh trưởng, phát triển và năng suất của một số loài cây trồng.
Thứ hai, những phân tích hệ gen học (genomic), phiên mã học (transcriptomic) và protein học (proteomic) trên hạt/cây xử lý MF cũng cần được tiến hành nhằm giải thích cho sự tăng/giảm quá trình trao đổi chất thông qua sự biểu hiện của các gen [9]. Để xử lý MF trở thành một giải pháp kỹ thuật, cần xem xét đến tính an toàn của sản phẩm nông sản thu hoạch từ cây trồng xử lý MF và ảnh hưởng đến cây trồng xử lý MF đến hệ vi sinh vật đất cũng như hệ sinh thái đồng ruộng [1, 2].
Thứ ba, kiểm soát được cường độ MF thích hợp có thể đem lại tiềm năng ứng dụng to lớn trong công nghệ tế bào thực vật ở Việt Nam. Các nghiên cứu in vitro đã chứng minh rằng, mẫu nuôi cấy mô đặt trong môi trường MF thích hợp có thể đẩy nhanh quá trình trao đổi chất [10]. Đây là một trong những ứng dụng rất lớn khi đề xuất xử lý MF vào quy trình nuôi cấy mô một số cây trồng quan trọng hiện nay.
TÀI LIỆU THAM KHẢO
[1] R. Radhakrishnan (2019), "Magnetic field regulates plant functions, growth and enhances tolerance against environmental stresses", Physiol. Mol. Biol. Plants, 25(5), pp.1107-1119.
[2] M. Sarraf, et al. (2020), "Magnetic field (MF) applications in plants: an overview", Plants, 9, DOI: 10.3390/plants9091139.
[3] V. Sukhov, et al. (2021), "Influence of magnetic field with Schumann resonance frequencies on photosynthetic light reactions in wheat and pea", Cells, 10, DOI: 10.3390/cells10010149.
[4] A.R. Liboff (2019), "Ion cyclotron resonance: geomagnetic strategy for living systems?", Electromagn Biol. Med., 38, pp.143-148.
[5] M. Islam, et al. (2020), "The geomagnetic field is a contributing factor for an efficient iron uptake in Arabidopsis thaliana", Front Plant Sci., 11, DOI: 10.3389/fpls.2020.00325.
[6] J. Alvarez, S. Martinez-Ramirez (2021), "Magneto-primed triticale seeds studied by micro-raman spectra", Plants, 10(6), DOI: 10.3390/plants10061083.
[7] A.A.H. Abdel Latef, et al. (2020), "Impact of the static magnetic field on growth, pigments, osmolytes, nitric oxide, hydrogen sulfide, phenylalanine ammonia-lyase activity, antioxidant defense system, and yield in lettuce", Biology, 9, DOI: 10.3390/biology9070172.
[8] R. Zhou, et al. (2016), "Effects of atmospheric-pressure N2, He, Air, and O2 microplasmas on mung bean seed germination and seedling growth", Sci. Rep., 6, DOI: 10.1038/srep32603.
[9] A. Shabrangy, et al. (2021), "Magnetic field induced changes in the shoot and root proteome of barley (Hordeum vulgare L.)", Front Plant Sci., 12, DOI: 10.3389/fpls.2021.622795. eCollection 2021.
[10] J.A. da Silva, J. Dobránszki (2016), "Magnetic fields: how is plant growth and development impacted?", Protoplasma, 253(2), pp.231-248.