Hạt cacbon nano và tiềm năng thay thế vật liệu phát quang truyền thống
Trong những thập kỷ qua, sự phát triển nhanh chóng của khoa học và công nghệ nano đã tác động đến hầu hết các lĩnh vực như sinh học, y học, điện tử, lượng tử ánh sáng, năng lượng... [1, 2]. Trong ứng dụng sinh học, vật liệu phát quang - chấm lượng tử bán dẫn (semiconductor quantum dots) thường được sử dụng để làm các đầu dò, chụp ảnh và đánh dấu sinh học [3]. Tuy nhiên, sự có mặt của một số kim loại nặng như cadimi, chì trong vật liệu nói trên dẫn đến những lo ngại về an toàn, có thể gây độc đối với con người và tác động không tốt đến môi trường [4]. Một số giải pháp khắc phục độc tính từ kim loại nặng như bọc bề mặt vật liệu bằng vật liệu silica hay polymer đã được thực hiện. Tuy nhiên, hiệu suất lượng tử cũng như quá trình chế tạo tốn kém đã dẫn đến những hạn chế nhất định [5].
Kể từ lần đầu tiên được phát hiện vào năm 2004, vật liệu CDs đã cho thấy những ưu điểm nổi trội như tính phát quang ổn định, độc tính thấp, tính tương thích sinh học tốt và quy trình chế tạo thân thiện với môi trường. Cấu trúc vật liệu cacbon nanodot (C-dots) gồm lõi là khối cầu cacbon lai hóa sp2/sp3 ở dạng vô định hình hoặc tinh thể, bao bọc bên ngoài là các nhóm chức. Với sự xuất hiện đa dạng các nhóm chức bao quanh, vật liệu C-dots có khả năng tan tốt trong nước và có tính tương thích sinh học cao, dễ dàng kết hợp với các cơ chất để phục vụ cho các ứng dụng. Bên cạnh đó, với đặc tính phát quang mạnh, ít bị tẩy màu (photoblaching) và có tính ổn định quang học tốt trong các môi trường có độ pH thay đổi lớn, vật liệu này còn được ứng dụng rộng rãi trong lĩnh vực cảm biến (sensing) để phát hiện một số loại ion kim loại như Cu2+, Fe3+, Hg2+… Những kết quả trên đang cho thấy CDs là vật liệu tiềm năng, có khả năng thay thế cho các vật liệu phát quang truyền thống.
Giải pháp chế tạo theo hướng tiếp cận xanh
Hiện nay, có rất nhiều nghiên cứu được tiến hành nhằm tìm ra phương pháp chế tạo hạt cacbon nano từ các vật liệu có nguồn gốc từ sinh khối. Với nỗ lực để cải thiện phương pháp chế tạo, hướng đến sự thân thiện với môi trường và hạn chế sử dụng hóa chất trong quá trình tổng hợp vật liệu nano, các nguyên liệu có nguồn gốc từ tự nhiên và vật liệu tái chế được xem là nguồn tiền chất lý tưởng để chế tạo hạt cacbon với các tính chất mong muốn. Bằng cách sử dụng phương pháp thủy nhiệt, nhóm nghiên cứu thuộc Trường Đại học Khoa học (Đại học Huế) cũng đã chế tạo thành công vật liệu hạt cacbon nano từ hạt kê, hạt đậu xanh, hoa Atiso, trái trứng gà, trái trứng cá và nút bấc. Ví dụ cho trường hợp sử dụng nút bấc, nhóm nghiên cứu đã sử dụng nút chai rượu Vang Đà Lạt của Công ty TNHH Ladofoods (Ladofoods, Lâm Đồng, Việt Nam) (Hình 1). Đầu tiên, nút chai rượu vang (5,0 g) được rửa bằng nước cất hai lần để loại bỏ bụi bẩn trên bề mặt và sấy khô trước khi cắt thành từng miếng nhỏ. Sau đó, chúng được hòa với 80 ml nước cất và cho vào bình Teflon100 ml. Hỗn hợp thu được sau đó được thủy nhiệt ở nhiệt độ 220oC trong thời gian 4 giờ. Sau khi được đưa về nhiệt độ phòng, dung dịch màu nâu đen được cho qua màng lọc 0,22 μm. Sau đó, dung dịch được ly tâm ở tốc độ 14.000 vòng/phút trong 15 phút để loại bỏ các hạt lớn. Cuối cùng, các hạt CDs thu được được bảo quản ở 4oC để sử dụng cho các nghiên cứu tiếp theo. Đối với các vật liệu có nguồn gốc tự nhiên khác, quy trình tương tự cũng được nhóm nghiên cứu áp dụng để chế tạo hạt cacbon nano.

Hình 1. Quy trình chế tạo vật liệu C-dots từ nút bấc. (a) Nút bấc từ chai rượu Vang, (b) Nút bấc cắt nhỏ được thủy nhiệt trong bình Teflon, (c) Sản phẩm C-dots dưới ánh sáng mặt trời, (d) Sản phẩm C-dots dưới ánh sáng đèn LED có bước sóng đỉnh ở 415 nm.
Một số nghiên cứu đã được thực hiện nhằm bước đầu đánh giá tiềm năng ứng dụng của vật liệu này trong nhuộm tế bào và phát hiện ion kim loại. Trong công bố năm 2019 của nhóm nghiên cứu, khi sử dụng mẫu tế bào ung thư cổ tử cung để kiểm tra, kết quả chụp ảnh dưới kính hiển vi huỳnh quang cho thấy sau khi được nuôi nhuộm trong môi trường có chứa hạt cacbon (chế tạo từ hạt kê), các nhóm nhỏ tế bào đã phát quang màu vàng và màu đỏ khi được kích thích lần lượt ở các bước sóng 488 nm và 561 nm (hình 2) [6].
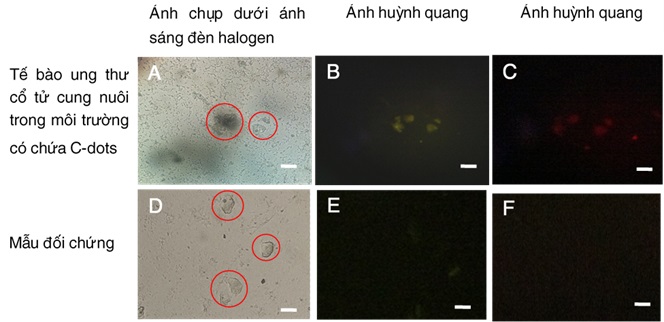
Hình 2. Ảnh chụp tế bào ung thư cổ tử cung dưới kính hiển vi huỳnh quang (độ phóng đại 40 x). Tế bào ung thư cổ tử cung được nuôi trong môi trường có chứa C-dots (a) và mẫu đối chứng (d) khi được chiếu bằng đèn halogen và ánh sáng có bước sóng 488 nm (b, e) và 561 nm (c, f). Thanh định cỡ có giá trị là 30 μm.
Các nghiên cứu chi tiết liên quan đến độc tính đối với tế bào của hệ vật liệu cacbon cũng được khảo sát. Trong đó, kết quả khảo sát với hạt cacbon nano chế tạo từ nút bấc cho thấy các tế bào gốc trung mô (MSCs) vẫn phát triển khá tốt khi hàm lượng cacbon trong môi trường nuôi lên đến 0,25 × (với 1 × = 0,51 mg/ml) (hình 3) [7].
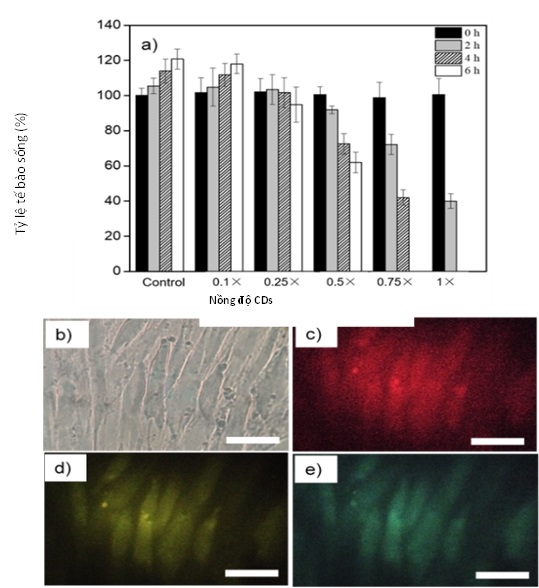
Hình 3. Độc tính tế bào và hình ảnh tế bào khi chụp dưới kính hiển vị huỳnh quang. (a) Tế bào MSCs được nuôi với CDs ở các nồng độ lần lượt là 0, 0,1×, 0,25×, 0,5×, 0,75× và 1× trong thời gian 0, 2, 4 và 6 giờ (1×=0,51 mg.ml-1). Tế bào MSCs sau khi nhuộm với CDs được chụp dưới (b) ánh sáng truyền qua, (c) ánh sáng xanh lục (515-560 nm), (d) ánh sáng xanh lam (450-490 nm), và (e) ánh sáng tím (320-380 nm). Thanh định cỡ là 50 µm.
Cũng trong một công bố khác gần đây của nhóm nghiên cứu, kết quả nghiên cứu việc sử dụng hạt cacbon (được chế tạo từ trái trứng gà) làm đầu dò chỉ thị chỉ thị huỳnh quang cho thấy vật liệu này có khả năng phát hiện các ion Fe3+ với ngưỡng thấp nhất là 19,0 µM (hình 4) [8].
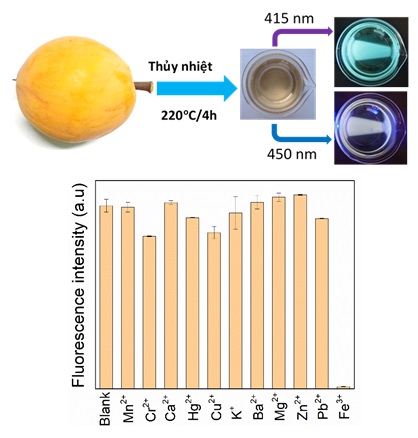
Hình 4. Tính chọn lọc của dung dịch chứa CDs trong khả năng chỉ thị huỳnh quang ion Fe3+. Sự xuất hiện của ion Fe3+ gây ra sự dập tắt cường độ huỳnh quang của dung dịch CDs mạnh hơn so với một số các ion kim loại khác.
Định hướng nghiên cứu
Tại Việt Nam, với đặc thù là một quốc gia có điều kiện tự nhiên thuận lợi như nóng ẩm, mưa nhiều, đất đai phì nhiêu nên hệ sinh khối phát triển rất đa dạng và phong phú. Tuy nhiên, các nghiên cứu hiện nay liên quan đến việc sử dụng nguồn nguyên liệu tự nhiên có tính đặc thù để chế tạo hạt cacbon vẫn còn rất hạn chế. Vì vậy, hướng nghiên cứu liên quan đến hạt cacbon nano (sử dụng nguồn nguyên liệu tự nhiên và tái chế) và định hướng ứng dụng sẽ là một bài toán mở, cần được dày công theo đuổi trong tương lai. Đơn cử như việc tổng hợp số lượng lớn hạt cacbon nano, dù có khá nhiều phương pháp chế tạo đã được phát triển, tuy nhiên việc đảm bảo sự ổn định các tính chất lý hóa khi quy mô tổng hợp vật liệu được mở rộng vẫn chưa được giải quyết triệt để. Bên cạnh đó, thuộc tính quang học của hạt cacbon nano vẫn đang là chủ đề còn nhiều tranh luận. Để định hướng cho các nghiên cứu trong tương lai, việc kết nối giữa nghiên cứu lý thuyết và thực nghiệm là vô cùng quan trọng, đây sẽ là cơ sở cho đề xuất lời giải thích thỏa đáng đối với tính chất quang học của hạt cacbon.
Tài liệu tham khảo
[1] C. Ding, et al. (2014), “Functional surface engineering of C-Dots for fluorescent biosensing and in vivo bioimaging”, ACS Publications, 1, pp.20-30.
[2] W. Li, et al. (2013), “An absolutely green approach to fabricate carbon nanodots from soya bean grounds”, RCS Advances, 43, DOI: 10.1039/C3RA43330G.
[3] B.A. Kairdolf, et al. ( 2013), “Semiconductor quantum dots for bioimaging and biodiagnostic applications”, National Library of Medicine, DOI: 10.1146/annurev-anchem-060908-155136.
[4] Y.Su, et al. (2009), “Cytotoxicity of cadmium based, aqueous phase - synthesized, quantum dots and its modulation by surface coating”, Biomaterials, 30(1), pp.19-25.
[5] Y. Choi, et al. (2009), “In situ visualization of gene expression using polymer-coated quantum-dot-dna conjugates”, Nano-micro small, DOI: 10.1002/smll.200900116.
[6] N.Q. Khoa, et al. (2019), “Low-cost synthesis of carbon nanodots from millets for bioimaging”, MRS Advances, 4(3-4), pp. 249-254.
[7] N.Q. Khoa, et al. (2022), “Hydrothermal synthesis of carbon nanodots from waste wine cork and their use in biocompatible fluorescence imaging”, New Carbon Materials, 37(3), pp.595-602.
[8] N.Q. Khoa (2022), “Sensitive detection of Fe3+ ions and cell imaging of carbon nanodots derived from canistel (Pouteria campechiana)”, MRS Advances, 7, pp.278-283.
Hình 3. Độc tính tế bào và hình ảnh tế bào khi chụp dưới kính hiển vị huỳnh quang. (a) Tế bào MSCs được nuôi với CDs ở các nồng độ lần lượt là 0, 0,1×, 0,25×, 0,5×, 0,75× và 1× trong thời gian 0, 2, 4 và 6 giờ (1×=0,51 mg.ml-1). Tế bào MSCs sau khi nhuộm với CDs được chụp dưới (b) ánh sáng truyền qua, (c) ánh sáng xanh lục (515-560 nm), (d) ánh sáng xanh lam (450-490 nm), và (e) ánh sáng tím (320-380 nm). Thanh định cỡ là 50 µm.
Cũng trong một công bố khác gần đây của nhóm nghiên cứu, kết quả nghiên cứu việc sử dụng hạt cacbon (được chế tạo từ trái trứng gà) làm đầu dò chỉ thị chỉ thị huỳnh quang cho thấy vật liệu này có khả năng phát hiện các ion Fe3+ với ngưỡng thấp nhất là 19,0 µM (hình 4) [8].