Công nghệ phát triển vắc xin có nguồn gốc từ thực vật
Vắc xin từ lâu được xem là phương thức hiệu quả nhằm ngăn ngừa các bệnh lý nguy hiểm. Cơ chế hoạt động của vắc xin là hình thành khả năng miễn dịch với tác nhân gây bệnh bằng cách đưa vào cơ thể một dạng "virus đặc biệt" đã được làm yếu (hầu như không có khả năng gây bệnh). Đây là phương pháp điều trị an toàn và đóng vai trò chủ đạo trong công tác kiểm soát dịch bệnh trên thế giới. Tuy nhiên, phần lớn các vắc xin hiện hành đều gây đáp ứng miễn dịch bằng con đường tiêm, vì thế tạo ra nhiều bất cập trong tiếp cận và bảo quản nguồn vắc xin ở những nước nghèo. Gần đây, sử dụng vắc xin có nguồn gốc từ thực vật được ghi nhận là một trong những cách tiếp cận mới giúp tiết kiệm chi phí sản xuất, rút gọn khâu quản lý… [1, 2].
Thực vật không chỉ cung cấp dinh dưỡng cho hoạt động sống của con người và động vật, mà còn là đối tượng được sử dụng để tổng hợp và sản xuất các hợp chất sinh học dưới dạng enzyme, chất điều tiết tăng trưởng, peptid hoặc thuốc kháng thể. Thực vật có thể tổng hợp ra một lượng lớn protein tái tổ hợp "sạch" và được bảo quản lạnh với chi phí thấp. Đến nay, nhiều hợp chất từ protein có tác dụng dược lý vốn được sản xuất từ nuôi cấy vi sinh vật, nấm, tế bào động vật có vú đã dần được chuyển sang xu hướng tổng hợp từ thực vật [3]. Trong đó, tổng hợp vắc xin từ thực vật có thể mở ra tiềm năng ứng dụng lớn (hình 1).
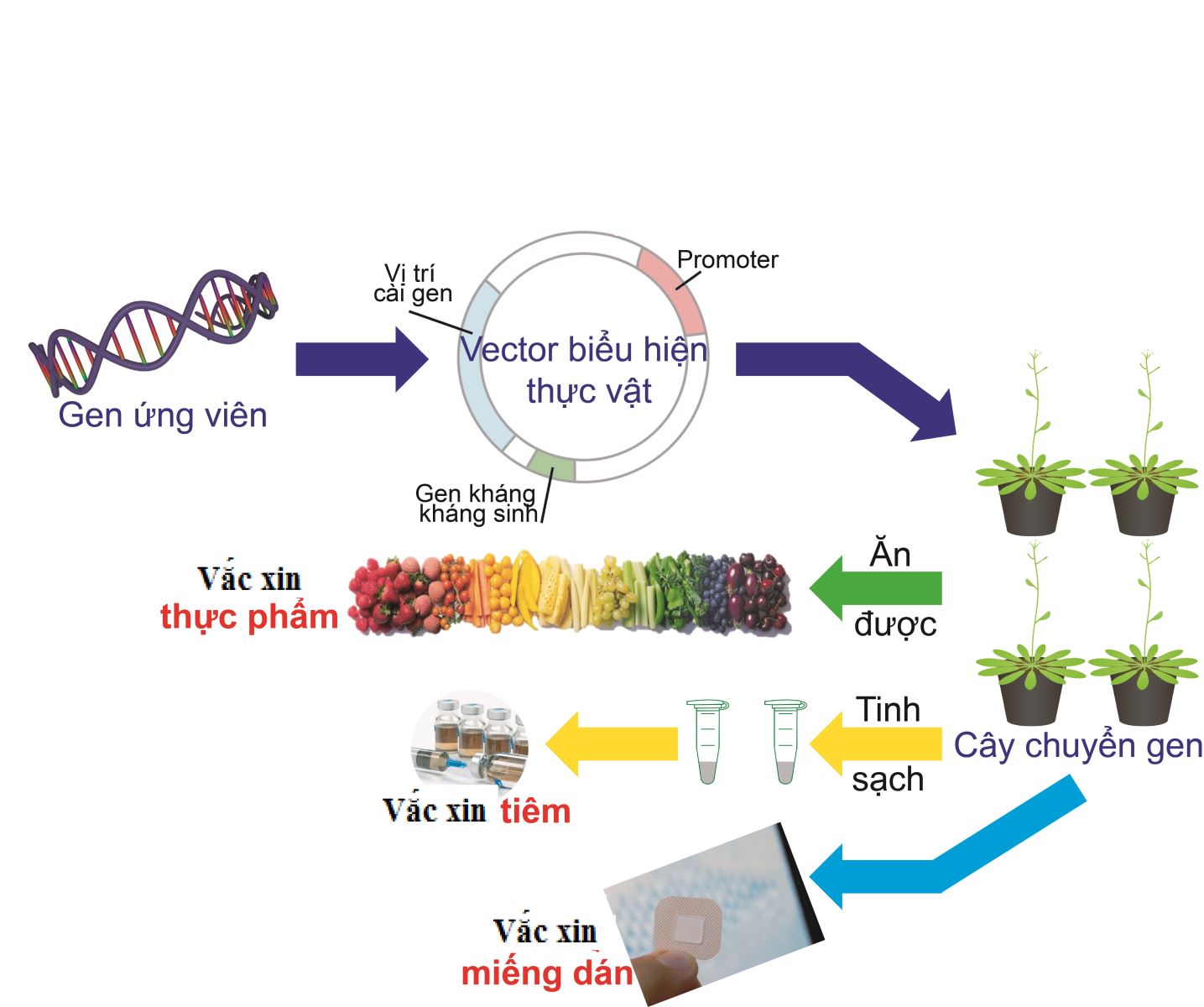
Hình 1. Tiềm năng sử dụng thực vật sản xuất vắc xin trong tương lai.
Một số loại cây trồng như thuốc lá, lúa gạo, ngô, khoai tây, cà chua, cà rốt, lạc và đậu tương đã được đề xuất để sản xuất vắc xin thực vật. Đây đều là những đối tượng nghiên cứu phổ biến, đã nắm rõ thông tin di truyền (hệ gen nhân và hệ gen tế bào chất), quy trình chuyển gen cũng như phương pháp nuôi cấy tế bào, không chứa độc tố, dễ tìm và trồng tại địa phương. Hơn nữa, để tạo ra thực vật sản xuất protein tái tổ hợp (vắc xin), các gen tái tổ hợp cần phải có mức độ biểu hiện cao, đảm bảo tính an toàn của protein tái tổ hợp để sử dụng ở người hoặc động vật. Sản xuất vắc xin có nguồn gốc thực vật chủ yếu dựa trên việc đưa gen kháng nguyên vào thực vật thông qua các công cụ ADN tái tổ hợp, như biến nạp gen nhân nhờ Agrobacterium, chuyển gen vào lục lạp, biểu hiện tạm thời. Cụ thể:
Biến nạp gen nhân nhờ Agrobacterium: đây là phương pháp truyền thống trong nghiên cứu chức năng gen ở thực vật nói chung. Ngân hàng các dòng chuyển gen mang vector biểu hiện liên tục gen mục tiêu sẽ được xây dựng nhằm sử dụng các cây chuyển gen tổng hợp vắc xin một cách ổn định. Tuy nhiên, sự phát triển của những dòng chuyển gen tốn rất nhiều thời gian và có thể bị ảnh hưởng bởi cơ chế làm câm lặng gen (gene silencing), tổn thương hệ gen vật chủ hoặc gây ra sự phát tán gen chuyển ra môi trường [1].
Chuyển gen vào lục lạp: hệ gen lục lạp thường chỉ chứa khoảng 100-250 gen, có khả năng di truyền theo dòng mẹ, vì vậy phù hợp cho việc tạo ra thực vật sản xuất vắc xin một cách ổn định mà không cần chuyển gen qua thụ phấn nhờ hạt phấn. Đến nay, hệ gen lục lạp của một số loài như thuốc lá, cà rốt, dạ yếu thảo và xà lách đã được sử dụng phổ biến để tổng hợp protein tái tổ hợp [4, 5].
Biểu hiện tạm thời thông qua các vector biểu hiện virus thực vật: điểm mạnh của phương pháp này là sử dụng các vector virus thực vật có biểu hiện tạm thời [như virus khảm thuốc lá (TMV), virus khảm đậu đũa (CPMV) và virus khoai tây (PVX)], có khả năng sao chép tốt trong cây chủ, dẫn đến hiệu suất tổng hợp vắc xin cao [4]. Tuy nhiên, những virus tái tổ hợp này có thể truyền nhiễm sang các loài thực vật khác, gây phát tán nguồn gen tái tổ hợp ra môi trường. Đến nay, vector virus thế hệ thứ hai đã được phát triển không những an toàn hơn trong môi trường tự nhiên mà còn thích hợp cho rất nhiều gen kháng nguyên. Các vector này được xây dựng dựa trên hệ thống xâm nhập có số lượng phần tử virus tối thiểu cần thiết để tiến hành sao chép vector, trong khi các chức năng khác được lấy từ thành phần không phải virus [4, 5].
Công nghệ xâm nhiễm sử dụng trong biểu hiện tạm thời: đây là một kỹ thuật phát triển từ phương pháp biểu hiện tạm thời truyền thống. Các nhà khoa học đã tiến hành “xâm nhiễm nông học” hoặc sử dụng hệ thống magnifection để "tiêm" Agrobacterium vào lá cây thuốc lá hoặc Arabidopsis. Kết quả đã tạo ra các dạng hạt tương tự virus bên trong các mô tế bào bị xâm nhiễm [6, 7]. Các vắc xin tổng hợp trong mô tế bào này sau đó có thể được đồng hóa trực tiếp hoặc tinh chế thành dạng viên uống. Tuy nhiên, các sản phẩm hiện vẫn đang trong quá trình thử nghiệm nhằm đánh giá mức độ an toàn và độc tính của hạt tương tự virus trên động vật.
Thành tựu trong sản xuất vắc xin từ thực vật
Dấu mốc đầu tiên cần được nhắc đến là việc lần đầu tiên đưa gen mã hóa nopaline synthase và hormone tăng trưởng ở người vào cây hoa hướng dương và thuốc lá bằng Ti plasmid vào năm 1986. Ngay sau đó, kháng thể đơn dòng ở chuột đã được tổng hợp trên lá cây thuốc lá (1989). Đến nay, hàng trăm protein tái tổ hợp đã được tạo ra từ các loài thực vật khác nhau phục vụ đời sống, điển hình như bovine trypsin (EC 3.4, 21.4) tổng hợp từ ngô chuyển gen đã được thương mại hóa từ năm 2002. Tuy nhiên, những vắc xin có nguồn gốc từ thực vật đến nay chưa được phê chuẩn và vẫn đang trong giai đoạn đánh giá độ an toàn, hiệu quả trong thử nghiệm lâm sàng (bảng 1).
Bảng 1. Những vắc xin dành cho người làm từ thực vật được thử nghiệm lâm sàng.
|
Mầm bệnh
|
Kháng nguyên
|
Thực vật
|
Thử nghiệm lâm sàng
|
|
Cúm H5N1
|
Hemagglutinin
|
Nicotiana benthamiana
|
Giai đoạn I/II
|
|
Cúm H1N1
|
Hemagglutinin
|
Nicotiana benthamiana
|
Giai đoạn I
|
|
Norovirus
|
Capsid protein
|
Khoai tây và thuốc lá
|
Giai đoạn I
|
|
Virus viêm gan B
|
Surface protein
|
Rau diếp
|
Giai đoạn I
|
|
Virus viêm gan B
|
Surface protein
|
Thuốc lá
|
Giai đoạn I
|
|
Virus dại
|
Glycoprotein và nucleoprotein
|
Rau chân vịt
|
Giai đoạn I
|
Trong đợt bùng phát bệnh sốt xuất huyết do virus Ebola ở người tại Tây Phi năm 2014, kháng thể kháng Ebola (ZMapp) sản xuất từ cây thuốc lá đã được phê chuẩn để sử dụng cho con người [8]. Cụ thể, các gen mã hóa 3 kháng thể đơn dòng thuộc nhóm IgG có chức năng bám lên vùng quyết định kháng nguyên (epitode) trên bề mặt glycoprotein của virus Ebola đã được chuyển vào cây thuốc lá [8]. Sau đó, cây thuốc lá được trồng trong nhà kính theo tiêu chuẩn cGMP trên hệ thống RAMP và MagnICON nhằm biểu hiện tạm thời vector có nguồn gốc từ virus trên lá thông qua Agrobacterium.
Trong một giả thuyết bùng phát đại dịch cúm A/H1N1, các hệ thống cây trồng trong nhà kính có thể đáp ứng được lượng vắc xin cung ứng kịp thời. Trong khi cần ít nhất 6 tháng sản xuất vắc xin làm từ trứng, vắc xin có nguồn gốc từ thực vật (kháng nguyên tinh khiết) có thể được sản xuất trong vòng 21 ngày kể từ khi xác định được trình tự của chủng gây bệnh [9]. Cụ thể, hệ thống chuyển gen tạm thời dựa trên Agrobacterium đã được áp dụng trên cây thuốc lá nhằm tạo ra một lượng lớn các hạt hemagglutinin, là dạng protein chính nhô ra bên ngoài vỏ của virus cúm A, quyết định kháng nguyên chính của virus [9]. Những vắc xin có nguồn gốc từ thực vật này đã được chứng minh có khả năng miễn dịch cao trong thử nghiệm lâm sàng trên động vật [3].
Đến nay, một số vắc xin thử nghiệm chống các bệnh như cúm, norovirus, virus viêm gan B hoặc virus dại đã được sản xuất thành công từ các loại thực vật chuyển gen (bảng 1). Các sản phẩm này đang được kiểm chứng độ an toàn và hiệu quả thông qua thử nghiệm lâm sàng. Không chỉ có vậy, vắc xin thực vật cũng đã được tạo ra phục vụ chữa trị một số bệnh thường gặp do nhiễm khuẩn, như tiêu chảy cấp do E. coli (chuyển gen kháng nguyên LT-B vào thuốc lá, khoai tây, ngô, đậu tương), bệnh tả do Vibrio cholera (chuyển gen kháng nguyên CT-B vào khoai tây, thuốc lá, cà chua, lúa gạo), uốn ván do Clostridium tetani (chuyển gen kháng nguyên TetC vào thuốc lá), dịch hạch do Yersinia pestis (chuyển gen kháng nguyên F1 và LcrV vào thuốc lá), bệnh Lyme do Borrelia burgdorferi (chuyển gen kháng nguyên OspA và OspA-T vào thuốc lá) [1, 4].
Đối với căn bệnh thế kỷ AIDS gây ra bởi lentivirus HIV, các nhà khoa học đã tổng hợp thành công các kháng nguyên đặc trưng cho HIV (C4V3, CTB-MPR, CTB-P1, Gp41, Multi-HIV, p17/p24, p24, Poly HIV) chuyển vào cây thuốc lá, Arabidopsis và xà lách [10]. Các thử nghiệm lâm sàng trên động vật (chuột, thỏ) đang được tiến hành nhằm đánh giá phản ứng tạo ra miễn dịch trên cơ thể [10].
Ngoài ra, vắc xin thực vật cũng đã bắt đầu được thử nghiệm trong điều trị một số dạng bệnh tự miễn như tiểu đường và viêm khớp. Cụ thể, các nhà khoa học đã chuyển thành công gen mã hóa cho protein GAD liên kết với tiểu đơn vị B vô hại từ Vibrio cholerae vào cây thuốc lá và khoai tây để điều trị bệnh tiểu đường liên quan đến decarboxylase kháng nguyên glutamic acid. Sử dụng cây hồng hoa có khả năng tổng hợp insulin để điều trị bệnh nhân tiểu đường.
Gần đây, các nhà khoa học đã bắt đầu có ý tưởng sử dụng vắc xin tổng hợp từ thực vật giúp chống lại đại dịch COVID-19 do virus SARS-CoV-2 gây ra. Thành công bước đầu trong việc sản xuất vắc xin thực vật để phòng MERS/SARS-CoV-1 đã mở ra cơ hội cho nghiên cứu và phát triển vắc xin có nguồn gốc thực vật chống lại COVID-19. Tổng hợp hạt tương tự virus, vắc xin mang nhiều epitope, tổng hợp phức hợp miễn dịch, dung hợp polypeptide tương tự sợi elastin được xem là những cách tiếp cận khả thi nhất nhằm phát triển vắc xin chống SARS-CoV-2 [11, 12].
Ở Việt Nam, nỗ lực của các nhà khoa học cũng đã được ghi nhận trong sản xuất protein kháng nguyên VP2 bằng kỹ thuật di truyền trên tế bào bèo tấm (Wolffia australiana) để bước đầu tổng hợp vắc xin phòng bệnh Gumboro cho gà. Kế thừa kết quả đó, công nghệ vector adenovirus tiếp tục được sử dụng để sản xuất vắc xin dạng adenovirus tái tổ hợp mang gen biểu hiện kháng nguyên VP2 thế hệ mới có thể sử dụng qua đường tiêu hóa, hô hấp và đường tiêm cho gà. Bên cạnh đó, Việt Nam cũng bước đầu thành công trong việc thiết kế cấu trúc vector biểu hiện mang gen mã hóa kháng nguyên HA của virus cúm A/H5N1 trên cây thuốc lá. Việc sản xuất kháng nguyên theo hướng này rất an toàn trong quá trình sản xuất vắc xin, nên thường được sử dụng đối với những vắc xin phòng bệnh nguy hiểm.
Thay lời kết
Khi công nghệ nhà kính truyền thống được kết hợp với kỹ thuật sinh học phân tử hiện đại, các nhà khoa học có thể xây dựng và phát triển nông trại sản xuất vắc xin có nguồn gốc từ thực vật bằng hệ thống canh tác tự động. Vắc xin có nguồn gốc từ thực vật có lợi thế về khả năng cung ứng, lưu trữ, hiệu suất tổng hợp, đặc biệt, có thể phát triển thành dạng vắc xin "ăn được" hoặc "uống được", giúp giảm bớt việc tiêm phòng. Bên cạnh đó, vắc xin tái tổ hợp có nguồn gốc từ thực vật được cho là "an toàn" hơn vắc xin truyền thống, bởi lẽ các protein này không hề chứa tác nhân gây bệnh "sống". Một số ưu điểm khác là chi phí sản xuất thấp và kỹ thuật tách chiết dễ dàng hơn so với sản phẩm có nguồn gốc từ E. coli, rất phù hợp với điều kiện ở những nước nghèo. Thêm vào đó, hệ thống biểu hiện thực vật an toàn hơn nền tảng biểu hiện thông thường vì thực vật không chứa những mầm bệnh của con người và động vật. Tuy vậy, vắc xin thực vật có thể không sử dụng được cho các trẻ sơ sinh, đồng thời liều lượng của vắc xin thực vật trong cây (hay năng suất biểu hiện kháng nguyên) có thể thay đổi theo độ tuổi của cây, kích thước sản phẩm (trái và củ). Ngoài ra, nếu kiểm soát không tốt có thể xảy ra vấn đề môi trường do phát tán nguồn gen và vắc xin thực vật có thể bị ô nhiễm bởi thuốc trừ bệnh hại trên cây.
TÀI LIỆU THAM KHẢO
[1] N. Takeyama, H. Kiyono, Y. Yuki (2015), "Plant-based vaccines for animals and humans: recent advances in technology and clinical trials", Ther. Adv. Vaccines, 3, pp.139-154.
[2] V. Yusibov, et al. (2006), "The potential of plant virus vectors for vaccine production", Drugs R.D., 7(4), pp.203-217.
[3] B.S. Shim, et al. (2019), "Plant factory: new resource for the productivity and diversity of human and veterinary vaccines", Clin. Exp. Vaccine Res., 8, pp.136-139.
[4] B. Gunasekaran, K.M. Gothandam (2020), "A review on edible vaccines and their prospects", Braz. J. Med. Biol. Res., 53(2), p.e8749.
[5] H.T. Phan, U. Conrad (2016), "Plant-based vaccine antigen production", Methods Mol. Biol., 1349, pp.35-47.
[6] I. Balke, A. Zeltins (2020), "Recent advances in the use of plant virus-like particles as vaccines", Viruses, 12(3), p.270.
[7] I. Balke, A. Zeltins (2019), "Use of plant viruses and virus-like particles for the creation of novel vaccines", Adv. Drug. Deliv. Rev., 145, pp.119-129.
[8] C. Arntzen (2015), "Plant-made pharmaceuticals: from 'edible vaccines' to Ebola therapeutics", Plant Biotechnol. J., 13(8), pp.1013-1016.
[9] M.A. D'Aoust, et al. (2010), "The production of hemagglutinin-based virus-like particles in plants: a rapid, efficient and safe response to pandemic influenza", Plant Biotechnol. J., 8(5), pp.607-619.
[10] J. Tremouillaux-Guiller, et al. (2020), "Plant-made HIV vaccines and potential candidates", Curr. Opin. Biotechnol., 61, pp.209-216.
[11] S. Rosales-Mendoza, et al. (2020), "What does plant-based vaccine technology offer to the fight against COVID-19?", Vaccines (Basel), 8(2), p.183.
[12] T. Capell, et al. (2020), "Potential applications of plant biotechnology against SARS-CoV-2", Trends in Plant Science, 25, pp.635-643.