
GS Drew Weissman GS Katalin Karikó
Vắc-xin trước khi bùng phát đại dịch COVID-19
Vắc-xin kích thích sự hình thành phản ứng miễn dịch đối với một mầm bệnh, để kích hoạt phản ứng miễn dịch, nhiều loại vắc-xin đã đưa mầm bệnh yếu hoặc bất hoạt vào cơ thể. Năm 1951, Max Theiler được trao Giải Nobel Y Sinh vì đã phát triển vắc-xin sốt vàng da. Nhờ những tiến bộ trong sinh học phân tử trong những thập kỷ gần đây, vắc-xin dựa trên các thành phần virus riêng lẻ chứ không phải toàn bộ virus đã được phát triển. Các phần của mã di truyền virus thường mã hóa các protein được tìm thấy trên bề mặt virus, được sử dụng để tạo ra các protein kích thích hình thành kháng thể ngăn chặn virus. Ví dụ như vắc-xin chống lại virus viêm gan B và virus u nhú ở người. Ngoài ra, các phần của mã di truyền virus có thể được chuyển sang virus mang mầm bệnh vô hại, một "vectơ". Phương pháp này được sử dụng trong vắc-xin chống lại virus Ebola. Khi tiêm vắc-xin vectơ, protein vi rút đã chọn sẽ được sản xuất trong tế bào của chúng ta, kích thích phản ứng miễn dịch chống lại vi rút mục tiêu.
Sản xuất vắc-xin dựa trên virus, protein và vectơ đòi hỏi phải nuôi cấy tế bào quy mô lớn. Quá trình sử dụng nhiều tài nguyên này hạn chế khả năng sản xuất vắc-xin nhanh chóng để ứng phó với các đợt bùng phát của đại dịch. Do đó, các nhà nghiên cứu từ lâu đã cố gắng phát triển các công nghệ vắc-xin độc lập với nuôi cấy tế bào.
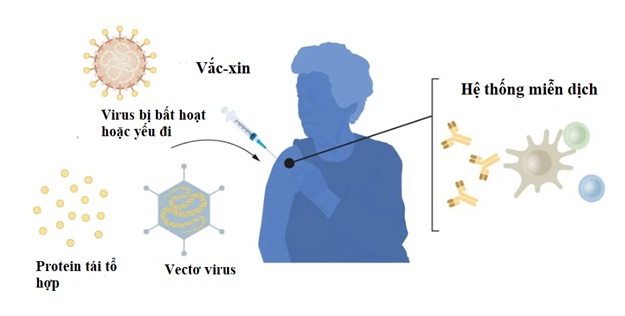
Hình 1. Phương pháp sản xuất vắc-xin trước đại dịch COVID-19 (ảnh: Ủy ban Nobel Y Sinh).
Vắc-xin mRNA - một ý tưởng đầy hứa hẹn
Trong những năm 1980, các phương pháp hiệu quả để sản xuất mRNA mà không cần nuôi cấy tế bào đã được giới thiệu, được gọi là phiên mã in vitro. Phương pháp này đã đẩy nhanh sự phát triển các ứng dụng sinh học phân tử trong một số lĩnh vực. Ý tưởng sử dụng công nghệ mRNA cho mục đích điều trị và làm vắc-xin cũng được triển khai, nhưng vẫn còn gặp phải nhiều rào cản. Bởi vì mRNA được phiên mã in vitro thường không ổn định và khó phân phối, đòi hỏi phải phát triển các hệ thống vận chuyển lipid phức tạp để bao bọc mRNA. Hơn nữa, mRNA được sản xuất trong ống nghiệm đã gây ra phản ứng viêm.
Những trở ngại này không làm nản lòng GS hóa sinh Katalin Karikó - người đã cống hiến hết mình cho việc phát triển các phương pháp sử dụng mRNA để trị liệu. Vào đầu những năm 1990, khi còn là trợ lý GS tại Đại học Pennsylvania (Mỹ), bà vẫn luôn giữ niềm đam mê để hiện thực hóa mRNA như một phương pháp trị liệu mặc dù gặp khó khăn trong việc thuyết phục các nhà tài trợ. Đồng nghiệp của GS Katalin Karikó tại trường đại học là GS miễn dịch học Drew Weissman. Ông quan tâm đến các tế bào đuôi gai, có chức năng quan trọng trong việc giám sát miễn dịch và kích hoạt các phản ứng miễn dịch do vắc-xin gây ra.
Phát hiện đột phá và hiện thực hóa vắc-xin mRNA
GS Katalin Karikó và GS Drew Weissman nhận thấy rằng, các tế bào đuôi gai của vius COVID-19 coi mRNA được phiên mã in vitro là một chất lạ, dẫn đến việc chúng kích hoạt và giải phóng các phân tử tín hiệu viêm. Họ tự hỏi tại sao mRNA được phiên mã trong ống nghiệm lại được coi là ngoại lai trong khi mRNA từ tế bào động vật có vú lại không gây ra phản ứng tương tự. Họ đã nhận ra rằng, một số đặc tính quan trọng giúp phân biệt các loại mRNA khác nhau.
RNA chứa 4 nucleoside (bazơ), viết tắt là A, U, G và C, tương ứng với A, T, G và C trong DNA, các chữ cái của mã di truyền. 2 nhà khoa học biết rằng, các bazơ trong RNA từ tế bào động vật có vú thường xuyên bị biến đổi về mặt hóa học, trong khi mRNA được phiên mã in vitro thì không. Họ tự hỏi liệu sự “vắng mặt” của các bazơ bị thay đổi trong RNA phiên mã in vitro có thể giải thích phản ứng viêm không mong muốn hay không. Để nghiên cứu điều này, họ đã tạo ra các biến thể khác nhau của mRNA, mỗi biến thể có những thay đổi hóa học riêng biệt trong các bazơ mà họ chuyển đến các tế bào đuôi gai. Kết quả đáng ngạc nhiên là phản ứng viêm gần như bị loại bỏ khi các biến đổi bazơ được đưa vào mRNA. Điều này đánh dấu sự thay đổi lớn trong hiểu biết của chúng ta về cách tế bào nhận biết và phản ứng với các dạng mRNA khác nhau. Những kết quả này được công bố vào năm 2005, 15 năm trước đại dịch COVID-19.
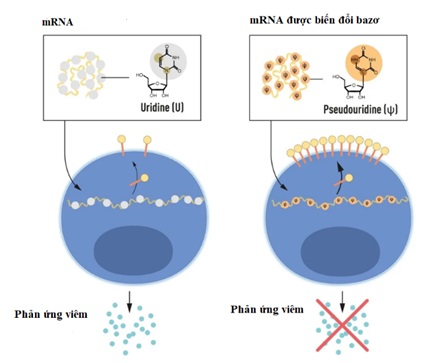
Hình 2. mRNA chứa bốn bazơ khác nhau, viết tắt là A, U, G và C. Chủ nhân của Giải thưởng Nobel năm nay đã phát hiện ra rằng, mRNA biến đổi bazơ có thể được sử dụng để ngăn chặn sự kích hoạt các phản ứng viêm và tăng sản xuất protein khi mRNA được đưa vào tế bào (ảnh: Ủy ban Nobel Y Sinh).
Trong các nghiên cứu sâu hơn được công bố vào năm 2008 và 2010, 2 nhà khoa học đã chỉ ra rằng, việc cung cấp mRNA được tạo ra bằng các sửa đổi bazơ đã làm tăng đáng kể việc sản xuất protein so với mRNA không được sửa đổi. Thông qua những khám phá về việc mRNA sửa đổi bazơ vừa làm giảm phản ứng viêm, vừa tăng sản xuất protein, các nhà khoa học đã giúp loại bỏ nhiều trở ngại trên con đường ứng dụng lâm sàng của mRNA.
Hiện thực hóa vắc-xin mRNA
Sau khi đại dịch COVID-19 bùng phát, 2 loại vắc-xin mRNA biến đổi bazơ mã hóa protein bề mặt SARS-CoV-2 (Pfizer và Moderna) đã được phát triển với tốc độ kỷ lục. 2 loại vắc-xin này có tác dụng bảo vệ được báo cáo là khoảng 95% và đều đã được phê duyệt vào tháng 12/2020.
Tính linh hoạt và tốc độ ấn tượng mà vắc-xin mRNA được phát triển đã mở đường cho việc sử dụng công nghệ này cho vắc-xin chống lại các bệnh khác như HIV, ung thư, tự miễn và bệnh di truyền. Trong tương lai, công nghệ này cũng có thể được sử dụng để cung cấp các protein trị liệu và điều trị một số loại ung thư.
Bắc Lê (theo The Nobel Prize)