Châu Phi: Lần đầu tiên có Cơ quan Quản lý Dược phẩm khu vực
Cơ quan Quản lý Dược phẩm châu Phi (AMA), cơ quan quản lý dược phẩm lớn đầu tiên được thành lập trong vòng 3 thập kỷ qua, được kỳ vọng mang đến cho châu Phi năng lực tự chủ để giải quyết những thách thức về sức khỏe và bệnh tật của lục địa này.

AMA và người điều hành: Thiết chế mới cho một nhiệm vụ lịch sử
Cơ quan Quản lý Dược phẩm châu Phi (AMA) đã chính thức ra mắt tại Mombasa (Kenya), trong khuôn khổ Hội nghị Khoa học về quản lý sản phẩm y tế châu Phi lần thứ 7.
Với phạm vi giám sát 55 quốc gia thuộc Liên minh châu Phi (AU), AMA được kỳ vọng trở thành trụ cột chuẩn hóa hệ thống quản lý dược vốn phân tán và thiếu năng lực nhiều thập kỷ qua.

Lãnh đạo của AMA gồm Tổng giám đốc đầu tiên - bà Delese Mimi Darko, cùng hội đồng quản trị bao gồm lãnh đạo cơ quan quản lý dược của năm khu vực Bắc - Tây - Trung - Đông - Nam Phi.
Bên cạnh đó là các ủy ban kỹ thuật phụ trách các lĩnh vực chuyên môn, bao gồm xây dựng tiêu chuẩn và quy định thống nhất cho hoạt động nghiên cứu y sinh trên toàn lục địa.
Dù 39/55 quốc gia AU đã ký hoặc phê chuẩn hiệp ước thành lập, song năng lực quản lý giữa các nước vẫn rất chênh lệch. Chỉ 9 quốc gia (Ai Cập, Ethiopia, Ghana, Nigeria, Rwanda, Senegal, Nam Phi, Tanzania và Zimbabwe) đạt mức 3 trên thang 4 điểm theo thang đánh giá của WHO về hệ thống quản lý hoạt động hiệu quả.
Điều này cho thấy một nhiệm vụ kép đặt lên vai AMA: Vừa điều phối chung vừa nâng cao tiêu chuẩn chung.
Để thực thi sứ mệnh đó, cơ quan này cần nguồn lực lớn và cam kết ổn định từ các chính phủ, điều vốn không dễ dàng trong bối cảnh hơn 30 quốc gia vẫn chi dưới 10% ngân sách cho y tế, thấp hơn hơn đáng kể so với mục tiêu 15% theo Tuyên bố Abuja.
Những lỗ hổng dữ liệu dược di truyền về người châu Phi và hệ lụy lâu dài
Dù sở hữu mức độ đa dạng di truyền cao nhất thế giới, châu Phi vẫn bị “bỏ quên” trong nghiên cứu dược học di truyền.
Dù chiếm 18% dân số và 25% gánh nặng bệnh tật toàn cầu, dữ liệu từ người có tổ tiên châu Phi chỉ chiếm 4% trong cơ sở dữ liệu PharmGKB - cơ sở dữ liệu công khai cung cấp thông tin về mối liên hệ giữa gene, thuốc và bệnh đến từ những người có tổ tiên châu Phiv
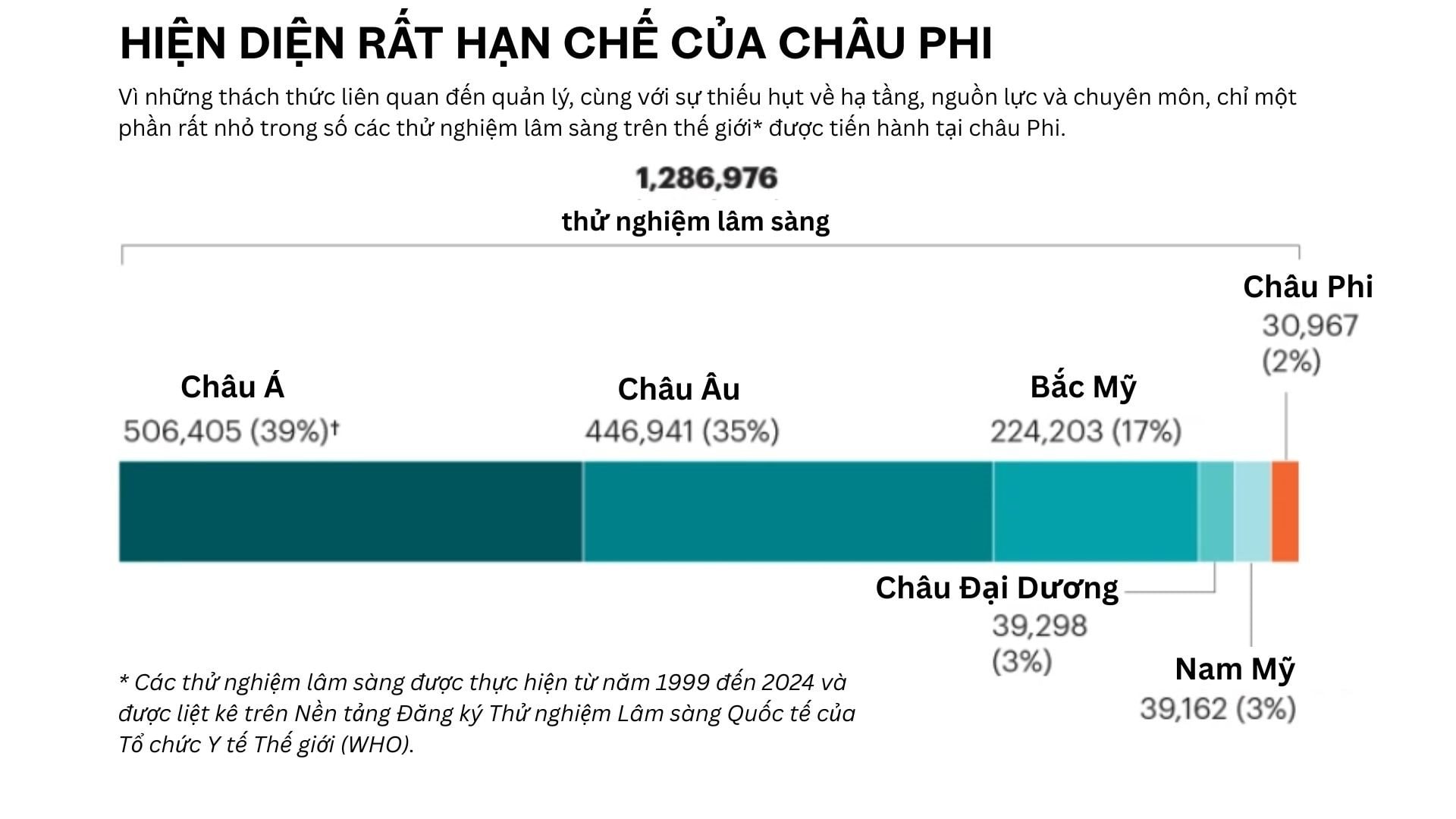
Một nghiên cứu công bố năm ngoái cho thấy rằng trong giai đoạn 2015 - 2023, trong hàng chục nghìn thử nghiệm giai đoạn I trên toàn cầu (đánh giá độ an toàn, tác dụng phụ và liều dùng tối ưu của thuốc), chỉ có 17 thử nghiệm được thực hiện ở Kenya, 12 ở Nigeria và 3 ở Ethiopia dù đây là những quốc gia đi đầu về nghiên cứu lâm sàng tại khu vực cận Sahara.
Sự thiếu vắng dữ liệu tạo ra hệ quả trực tiếp: Nhiều thuốc kém hiệu quả hoặc gây hại cho người châu Phi.
Thí dụ điển hình là efavirenz - thành phần chủ đạo trong phác đồ điều trị kháng virus (ARV) tuyến đầu ở châu Phi và trên thế giới - từng gây nhiễm độc thần kinh ở bệnh nhân HIV tại Zimbabwe do biến thể gene CYP2B6 ảnh hưởng đến chuyển hóa thuốc
Tương tự, bệnh hồng cầu hình liềm ảnh hưởng tới khoảng 1/100 người Tây Phi lại nhận được rất ít đầu tư nghiên cứu so với bệnh Parkinson (chủ yếu xảy ra tại châu Á, châu Âu và Bắc Mỹ), dù số ca tử vong toàn cầu tương đương.
Trong bối cảnh đó, AMA không chỉ là một cơ quan phê duyệt thuốc mà còn là thử nghiệm quan trọng xem liệu châu Phi có thể xây dựng hệ sinh thái khoa học phù hợp với chính người dân của mình, thay vì phụ thuộc mô hình và dữ liệu từ phương Tây.
AMA cần làm gì để hoàn thành vai trò?
Tích hợp dữ liệu người châu Phi vào toàn bộ chu trình phát triển thuốc
Để bảo đảm sự đa dạng hệ gene của người châu Phi cũng như những nhu cầu sức khỏe đặc thù của lục địa được lồng ghép đầy đủ vào mọi giai đoạn phát hiện và phát triển thuốc, AMA cần bảo đảm rằng dữ liệu dược học di truyền của người châu Phi được tích hợp ngay từ đầu vào quá trình nghiên cứu.
Cơ quan này cũng phải yêu cầu hoặc khuyến khích việc sử dụng các mô hình in vitro (nghiên cứu trong ống nghiệm) phát triển từ tế bào hoặc mô của những người mang nguồn gốc châu Phi.

Để làm được điều này, AMA nên yêu cầu các đơn vị xin cấp phép chứng minh cách họ đã tính đến biến thiên di truyền của người châu Phi, đặc biệt là biến thể trong họ gene cytochrome P450 (CYP) liên quan chuyển hóa thuốc hay gene APOL1 liên quan nguy cơ bệnh thận.
AMA cũng cần yêu cầu các nhà nghiên cứu sử dụng mô hình phát triển từ tế bào hoặc mô của những người mang nguồn gốc châu Phi trong mọi nghiên cứu về độc tính, hiệu quả, chuyển hóa thuốc và dược động học.
Để khuyến khích các nhà phát triển tiếp tục đưa sản phẩm sang giai đoạn thử nghiệm tiếp theo, AMA có thể triển khai cơ chế xét duyệt nhanh hoặc giảm phí hồ sơ đối với những nghiên cứu tiền lâm sàng sử dụng các công cụ “phù hợp với châu Phi”.
Hợp tác với viện nghiên cứu, biobank và áp dụng AI
AMA cần thúc đẩy mạng lưới hợp tác với các cơ sở học thuật ở châu Phi, như Trung tâm Nghiên cứu và Phát triển Thuốc toàn diện tại Đại học Cape Town (Nam Phi) cùng các nhà tài trợ quốc tế và Sáng kiến Dược phẩm Đổi mới - mô hình hợp tác công - tư giữa Liên minh châu Âu và ngành khoa học sự sống châu Âu.

Trọng tâm là xây dựng ngân hàng sinh học (biobank) trên quy mô lớn, nơi lưu trữ mẫu mô, dữ liệu gen, bệnh học của nhiều nhóm dân cư châu Phi. Khi được kết nối với các nền tảng dữ liệu mở như PharmGKB, những biobank này có thể được khai thác cùng với trí tuệ nhân tạo và các công cụ tính toán khác để dự đoán phản ứng thuốc, xác định nguy cơ bệnh theo từng nhóm dân cư.
Điều này sẽ mang lại lợi ích không chỉ cho châu Phi mà còn cho các hãng dược toàn cầu vốn đang chuyển sang mô hình phát triển thuốc dựa trên dữ liệu và thuật toán.
Hài hòa hóa môi trường quản lý: Chìa khóa để tăng thử nghiệm lâm sàng tại châu Phi
Một trong những rào cản lớn nhất hiện nay là tình trạng thiếu hoặc yếu kém về phòng thí nghiệm và hạ tầng; thiếu hụt các nhà khoa học được đào tạo để triển khai thử nghiệm lâm sàng; thiếu chuyên gia về đạo đức nghiên cứu và quản lý; cùng sự khác biệt giữa các quốc gia trong luật pháp và tiêu chuẩn về xử lý mẫu sinh học.

AMA có thể gia tăng số lượng thử nghiệm giai đoạn I tại châu Phi bằng cách thúc đẩy hợp tác giữa các cơ sở nghiên cứu trong khu vực. Cơ quan này cũng có thể phối hợp với các tổ chức châu lục, như Văn phòng Khu vực châu Phi của Viện Vắc xin Quốc tế nhằm nâng cao năng lực nghiên cứu và phát triển vắc xin tại châu Phi.
Để bảo đảm sự phối hợp giữa các quốc gia, AMA cần hỗ trợ xây dựng cơ sở dữ liệu trung tâm cho các thử nghiệm lâm sàng được tiến hành tại châu Phi, có thể dựa trên công việc của Clinical Trials Community Africa Network. Mạng lưới này tập hợp các ủy ban đạo đức nghiên cứu, viện nghiên cứu và công ty dược để kết nối các điểm nghiên cứu và phòng thí nghiệm, hướng tới chuẩn hóa thử nghiệm lâm sàng tại châu Phi.

Với vai trò điều phối trung tâm, AMA có thể điều phối quy trình thẩm định hồ sơ thử nghiệm lâm sàn, tạo nền tảng cho các thử nghiệm giai đoạn II, III, IV quy mô lớn, đa quốc gia - đa quốc gia - thứ mà từng quốc gia đơn lẻ không thể đảm nhiệm.
Đặc biệt, Tạp chí Nature chỉ ra 5 “cái bẫy” AMA phải tránh: (1) Để các quốc gia đi theo những hướng khác nhau, làm xói mòn niềm tin vào sản phẩm được AMA phê duyệt; (2) phê duyệt vội vàng; (3) quan liêu, dẫn đến chậm phê duyệt thuốc; (4) hình thức, không có năng lực vận hành thực sự; (5) Không đảm bảo tính độc lập, dẫn tới nguy cơ can thiệp chính trị hoặc lợi ích thương mại chi phối quyết định khoa học.
Bảo đảm tài chính bền vững cho AMA
Nguồn tài chính của AMA hiện đến từ nhiều kênh, gồm khoản tài trợ 5 năm trị giá 100 triệu euro (116 triệu USD) từ Ủy ban châu Âu, EMA, một số quốc gia thành viên EU và Quỹ Gates; khoản tài trợ 12,3 triệu USD từ tổ chức Wellcome có trụ sở tại London; cùng các đóng góp thường xuyên từ các quốc gia thành viên AU.
Tuy nhiên, khả năng vận hành bền vững và hiệu quả lâu dài của AMA phụ thuộc vào việc đảm bảo nguồn tài chính đầy đủ và ổn định. Sự hỗ trợ ổn định từ các nước thành viên AU sẽ đóng vai trò then chốt. Ở khía cạnh này, ZAZIBONA - một sáng kiến quản lý dược của 9 quốc gia ở miền Nam châu Phi - là một mô hình tham khảo. Chương trình này nhằm đẩy nhanh quy trình phê duyệt thuốc và chủ yếu dựa vào phí từ các đơn vị nộp hồ sơ để tài trợ cho hoạt động thanh tra.
Giá trị cốt lõi: Bình đẳng là quyền, và chủ quyền y tế gắn liền với chủ quyền quản lý dược
Suốt hàng chục năm, châu Phi chủ yếu tiếp nhận thuốc và vaccine được phát triển ở nơi khác. Người dân châu Phi cũng chủ yếu sử dụng những phương pháp điều trị được thử nghiệm trên các nhóm dân số không có đặc điểm di truyền hoặc sinh học tương đồng.
AMA ra đời để thay đổi điều đó và cần gửi đi một thông điệp rõ ràng: Bình đẳng y tế không phải là sự ban phát, mà là một quyền lợi chính đáng; và chủ quyền y tế công cộng không thể tách rời khỏi chủ quyền quản lý dược.
Nếu thành công, AMA không chỉ cải thiện sức khỏe của hàng tỷ người gốc Phi, mà còn tái định nghĩa cách thế giới phát triển thuốc - hướng tới một kỷ nguyên mà mọi cộng đồng đều được đại diện trong khoa học, và mọi người đều có quyền hưởng các liệu pháp an toàn, phù hợp với chính họ./.
